
РЕЗЮМЕ
Работы последних лет показали, что способность к распознаванию молекул MHC является врожденным свойством репертуара Т-клеток. Такое свойство предполагает наличие структурных ограничений во взаимодействии молекул MHC с рецепторами Т-лимфоцитов. С целью выявления молекулярных основ таких ограничений в этой работе проанализирован широкий спектр аллельных вариантов классических молекул MHC класса I представителей различных таксономических групп. Обнаружено, что в первичной структуре всех исследованных аллельных продуктов плацентарных млекопитающих в одних и тех же позициях присутствуют инвариантные аминокислотные остатки, составляющие мотив, общий для молекул MHC класса I этой таксономической группы. Из 179 проанализированных аминокислотных остатков доменов a1 и a2 30 являются инвариантными и 22 представлены "молчащими" аминокислотными заменами, 89 - консервативными и могут быть представлены не более, чем двумя-пятью вариантами аминокислотных замен и 38 - вариабельными, которые могут быть представлены шестью и более вариантами замен. Пространственная локализация инвариантных остатков в структуре молекул MHC показывает, что они, главным образом, присутствуют в областях контакта b -складчатых структур с a-спиралями, в "петлях" перехода b -складок друг в друга, а также в a-спиральные структуры и, таким образом, могут участвовать в формировании внутримолекулярных взаимодействий, определяющих третичную структуру молекул этого класса. Эта группа аминокислотных остатков наиболее консервативна в эволюции - образуемые ими мотивы обнаруживаются у представителей других классов позвоночных и даже у хрящевых рыб. В отличие от существующих представлений, связывающих вариабельность структуры молекул MHC с антигенсвязывающим регионом, большинство - 16 вариабельных остатков - локализованы в a-спиралях в позициях, способных влиять на взаимодействие с TCR и лишь 9 - в позициях, влияющих на взаимодействие с пептидом. Пять вариабельных остатков (АА 63, 77, 147, 152 и 156), расположенных в местах контакта a-спиралей с b-слоями, формируют своего рода "шарнирные области" молекулы, образуя пары с вариабельными остатками b-складок (АА 45, 95, 116, 114 и 113), соответственно. Именно в этих позициях часто наблюдаются аминокислотные замены у мутантных форм молекул MHC класса I, способных к индукции аллогенного ответа у животных дикого типа, что говорит об особой важности таких "шарнирных областей" в формировании аллоантигенных свойств молекул MHC класса I. С целью оценки функциональной значимости выявленных мотивов и спектра возможных вариаций аминокислотных остатков была проведена оценка их соответствия последовательностям ряда неклассических молекул MHC млекопитающих. Эта оценка показала, что подавляющее большинство проанализированных вариантов неклассических молекул MHC содержат по меньшей мере по одной замене какого-либо из инвариантных остатков, а также множественные аминокислотные замены как в консервативных, так и в вариабельных остатках, отличающие их от классических. Выявленный мотив тесно связан с функциями последних. Он наиболее точно описывает спектр вариантов аминокислотных остатков, способных влиять на связывание и презентацию антигенных пептидов и на взаимодействие a -спиралей и b-слоев. Мотив, выявленный в структуре молекул MHC класса I, позволил обнаружить короткий фрагмент, в котором наблюдается максимальное сходство между молекулами MHC классов I и II. Этот фрагмент, локализованый в районе аномальной укладки a-спирали в a2-домене молекул MHC класса I и в b-цепях молекул MHC класса II, может играть роль "якоря" для взаимодействия с Т-клеточным рецептором.
Принятые сокращения: MHC - major histocompatibility complex - главный комплекс гистосовместимости, TCR - T cell receptor - Т-клеточный рецептор. *- автор для переписки: 115478, г. Москва, Каширское шоссе 24, НИИ канцерогенеза РОНЦ РАМН, Лаб. Механизмов регуляции иммунитета. E-mail: kazansky@dataforce.net
ВВЕДЕНИЕ
Важнейшей функцией молекул MHC является связывание и презентация пептидов патогенов, а также собственных белков организма рецепторам Т-лимфоцитов. С этой способностью связана другая важнейшая функция MHC - селекция и формирование репертуара Т-клеток, обладающего способностью отличать "свое" от "чужого". Высокая аллельная гетерогенность этого типа молекул с одной стороны, способствует увеличению числа вариантов пептидов различных патогенов, способных быть представленными Т-клеткам организма и распознанным ими. С другой стороны, она является существенной помехой на пути успешной трансплантации органов и тканей, поскольку различия по MHC приводят к развитию мощных реакций отторжения из-за развития аллогенного ответа, в который вовлечена значительная доля репертуара Т-клеток (согласно некоторым оценкам, до 10% клонов Т-клеток). Причины такой интенсивной реакции на аллельные формы молекул MHC остаются неясными. В 1996 году было сделано открытие, недооцененное большинством иммунологов. Jens Zerrahn, Werner Held и David H. Raulet установили, что способность Т-клеточных рецепторов к взаимодействию с молекулами MHC не формируется в процессе тимусной селекции, как полагали ранее, а присутствует в репертуаре исходно. Иными словами, аллореактивность является врожденным свойством репертуара Т-клеток. Стимулируя искусственно антителами к TCRa/b и CD4 развитие Т-клеток в фетальных органных культурах тимуса мыши с нокаутированными генами MHC, они показали, что в образующемся репертуаре с высокой частотой встречаются клетки, способные к взаимодействию с различными аллельными формами молекул MHC, хотя в процессе своего развития Т-клетки такого репертуара не имели возможности "увидеть" какую-либо из них и, следовательно, "научиться" их распознавать. Определенные частоты таких клеток были сопоставимы с частотами аллореактивных клеток в репертуаре нормальных мышей, что позволило авторам заключить, что способность к взаимодействию с продуктами MHC присутствует у репертуара Т-клеток исходно, до прохождения процессов позитивной и негативной селекции в тимусе [1]. Фактически, это открытие перевернуло систему представлений, сложившуюся в сознании иммунологов к этому времени. До него полагали, что способность Т-клеток к взаимодействию с молекулами MHC является следствием отбора случайно реаранжированных рецепторов Т-клеток в тимусе по способности реагировать с ними. Способность же зрелых Т-клеток к распознаванию чужеродных трансплантационных антигенов понималась как следствие этого отбора, выражающееся в перекрестных реакциях репертуара. Врожденная способность к распознаванию Т-клетками молекул MHC с неизбежностью ставит вопрос о том, каковы структурные ограничения этого процесса. Хотя в последнее время появился ряд блестящих кристаллографических исследований взаимодействий TCR с молекулами MHC, трудоемкость исследований в этой области, ограниченных единичными вариантами комбинаций TCR/MHC/пептид, весьма нескоро позволит сделать значимые обобщения о природе этих взаимодействий. Результаты этих исследований, подтвержденные мутационным анализом, показали, что C-концевые участки a -спиралей доменов a1 и a2 молекул MHC класса I играют большую роль во взаимодействии с CDR1 и CDR2 районами TCR, обеспечивая его правильную ориентацию на молекуле гистосовместимости [2-5]. В 1998 г. нами были опубликованы результаты исследования последовательностей мутантных форм молекул MHC класса I мыши, содержащих единичные аминокислотные замены в различных регионах молекулы MHC, которые приводят к появлению у этой молекулы аллореактивности - т. е. способности активировать значительную долю репертуара Т-лимфоцитов реципиента дикого типа. Тогда мы обнаружили, что точечные мутации, приводящие к аллореактивности, всегда сопровождаются появлением в мутантном регионе молекулы фрагмента, идентичного по последовательности такому же фрагменту какой-либо из существующих молекул MHC класса I известных гаплотипов. Это наблюдение позволило нам предположить, что в основе явления аллореактивности лежит строго ограниченный спектр аминокислотных замен в первичной структуре молекул MHC и что именно этим можно объяснить, почему столь высокий процент Т-клеток принимает участие в ответе на аллогенные молекулы MHC [6]. Неожиданным оказался тот факт, что даже если образующийся в результате мутации фрагмент последовательности не обнаруживался среди молекул MHC мыши, его можно было найти в молекулах MHC других видов млекопитающих. Недавно стало известно, что распознавание молекул MHC рецепторами Т-клеток не имеет видовых ограничений - для него важно совпадение в видовой специфичности лишь акцессорных молекул (корецепторов, костимуляторных лигандов, цитокинов и их рецепторов), участвующих в иммунном ответе [7]. По этой причине подробное исследование вариабельности первичной структуры молекул MHC класса I млекопитающих могло бы стать весьма информативным для углубленного понимания их функций. В этой работе предпринята попытка оценить вариабельность индивидуальных аминокислотных остатков доменов a1 и a2 среди широкого ряда аллельных форм молекул MHC класса I млекопитающих, определить, может ли существовать мотив, общий для молекул этого типа, сопоставить его с первичной структурой неклассических молекул MHC класса I и молекул MHC класса II.
УСЛОВИЯ ЭКСПЕРИМЕНТА
В работе проанализировано 18 аллельных форм классических молекул MHC класса I мыши (Mus musculus), 197 - человека (Homo sapiens), 8 - быка (Bos taurus), 4 - собаки (Canis familiaris), 10 - кошки (Felis catus), 11 - лошади (Equus caballus), 8 - крысы (Rattus norvegicus), 15 - макаки-резуса (Macaca mulatta), 3 - кролика (Oryctolagus cuniculus), 1 - пятнистого тюленя (Phoca vitulina), 9 - голубого коала (Phascolarctos cinereus), 5 - кенгуру Бенетта (Macropus rufogriseus), 3 - серого короткохвостого опоссума (Monodelphis domestica), 28 - курицы (Gallus gallus), 5 - африканской шпорцевой лягушки (Xenopus laevis), 5 - zebra fish (Danio rerio), 38 - куньей акулы (Triakis scyllium), полученных из базы данных NCBI (http://www.ncbi.nlm.nih.gov). Проанализированы также неклассические молекулы MHC класса I: 19 форм мыши, 9 - человека, 3 - свиньи (Sus scrofa), 1 - обезьяны (Saguinus oedipus), 5 - крысы (Rattus norvegicus). Для определения мотивов и поиска гомологий использована программа BLAST (http://www.ncbi.nlm.nih.gov/blast/index.html). Пространственную локализацию аминокислотных остатков определяли с помощью программы Cn3D и файлов из базы данных NCBI, содержащей модели молекул H-2Kb, H-2Db, H-2Ld, Qa-2, I-Ak, I-Eq мыши и HLA-A2 человека. Для оценки точности полученного результата использована дополнительная независимая группа классических молекул MHC класса I, включившая 58 последовательностей: 47 - свиньи (Sus scrofa), 1 - золотистого хомячка (Mesocricetus auratus), 4 - овцы (Ovis aries), 1- гепарда (Acinonyx jubatus), 2 - леопарда (Leopardus pardalis), 3 - малого двурогого носорога (Diceros bicornis minor).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ ИССЛЕДОВАНИЙ
Поиск мотива, общего для молекул MHC млекопитающих. Одной из существенных характеристик различных функциональных типов белковых молекул является наличие в их первичной структуре мотивов, связанных с теми или иными функциями. В последнее время накопилось много данных о первичной структуре молекул MHC разных видов животных. Поэтому представляло интерес применить к их анализу подход, основанный на поиске общих мотивов в первичной структуре, что позволило бы лучше понять их связь с функциями. Предварительный анализ вариантов первичной структуры доменов a1 и a2 классических молекул MHC класса I различных видов млекопитающих с помощью программы BLAST показал, что в отличие от видов других таксономических групп, у плацентарных млекопитающих длина звеньев, ограниченных гомологичными аминокислотными остатками одинакова - у них не обнаруживается вариабельности, обусловленной наличием "вставок" или "щелей" (Рис. 1).

Это обстоятельство сделало возможным поиск общего мотива в первичной структуре молекул MHC класса I плацентарных млекопитающих. Результаты, представленные на Рис. 2, показывают локализацию инвариантных аминокислотных остатков в доменах a1 и a2, выявленных в результате анализа широкого ряда аллельных форм молекул MHC класса I млекопитающих.

Для сравнения представлен мотив, общий для молекул MHC класса I куньей акулы (Triakis scyllium). Хорошо видно, что несмотря на различия в длине некоторых фрагментов, ограниченных гомологичными аминокислотными остатками, в первичной структуре молекул MHC млекопитающих и акулы обнаруживается существенное сходство, обусловленное наличием множества общих инвариантных остатков в гомологичных позициях, что говорит об их существенном консерватизме в эволюции и важности для поддержания структуры и функций молекул MHC. С помощью программы Cn3D была определена пространственная локализация выявленных инвариантных аминокислотных остатков в молекулах MHC млекопитающих. Результаты представлены на Рис. 3.

Хорошо видно, что инвариантные остатки присутствуют, главным образом, в областях контакта b-складчатых структур с a-спиралями, в "петлях" перехода b-складок друг в друга, а также в a -спиральные структуры. Такое расположение говорит о том, что роль инвариантных остатков состоит в формировании внутримолекулярных взаимодействий, определяющих третичную структуру молекул MHC класса I. Существует несколько областей, в которых инвариантному остатку a-спирали противостоит инвариантный остаток b-складки (164C-101C, 140A-135A, 60W-47P, 172L-28V, 179L-28V). По всей видимости, взаимодействия между этими остатками стабилизируют взаимное расположение a-спиралей и b-слоев, создавая своего рода каркас молекул гистосовместимости. Таким образом, результаты, полученные в данной работе, показывают, что структуры классических молекул MHC различных таксономических групп животных имеют черты существенного сходства, сосредоточенные в структурах, определяющих внутримолекулярные взаимодействия.
Описание мотива в первичной структуре молекул MHC класса I плацентарных млекопитающих
Результаты, изложенные выше, дали основание провести подробный анализ с целью идентификации единого мотива в первичной структуре молекул класса I плацентарных млекопитающих. Был проведен поиск инвариантных аминокислотных остатков, а также остатков, представленных консервативными заменами. Результат анализа 275 аллельных форм, встречающихся у различных видов, представлен на Рис. 4.

Оценка вариабельности и пространственного расположения вариабельных аминокислотных остатков доменов a1 и a2 молекул MHC млекопитающих
Описание мотива, общего для доменов a1 и a2 молекул MHC млекопитающих было бы неполным без оценки полного спектра вариаций индивидуальных аминокислотных остатков. Результаты оценки такой вариабельности приведены в таблице 1.

Как видно из таблицы, из 179 аминокислотных остатков 52 являются инвариантными либо представлены консервативными заменами. Подавляющее большинство аминокислотных остатков (89) консервативны и во всем спектре исследованных аллельных форм молекул MHC класса I млекопитающих могут быть представлены не более, чем пятью заменами. Вариабельные остатки, представленные шестью и более вариантами замен аминокислотных остатков обнаруживаются в 38 позициях двух первых доменов. Исследование их пространственной локализации привело к ряду неожиданных результатов (Рис. 5).
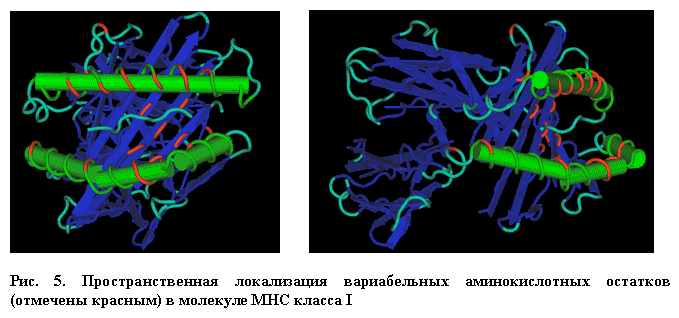
Если ранее полагали, что большинство вариабельных аминокислотных остатков обращены в антигенсвязывающую область молекулы MHC либо находятся в b-складках, ее "выстилающих" и, таким образом, влияют на связывание антигенных пептидов [8], то результаты данного исследования делают такое представление чрезмерно упрощенным (Табл. 2).
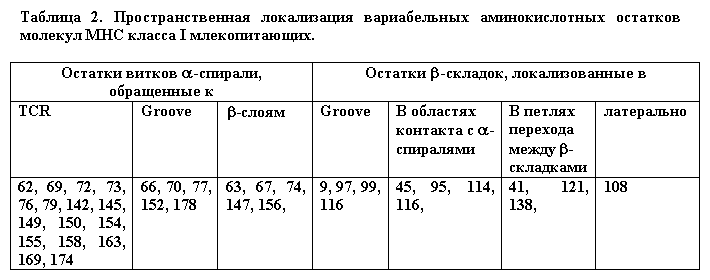
Лишь 5 вариабельных аминокислотных остатков a-спиралей участвуют в формировании антигенсвязывающей области и лишь 4 остатка обнаруживаются в b-слоях, выстилающих ее. Большинство вариабельных остатков (16) оказались в частях витков a-спиралей, обращенных к TCR, 5 остатков - в областях a-спиралей, взаимодействующих с b-слоями, 4 - в областях b-слоев, взаимодействующих с a-спиралями и 3 - в петлях перехода между структурами. При просмотре расположения вариабельных остатков на пространственных моделях молекул MHC было обнаружено, что в непосредственной близости от вариабельных остатков b-слоев часто обнаруживаются вариабельные остатки a-спиралей. Таким образом, в третичной структуре молекулы MHC образуются пары вариабельных остатков 45-63, 95-77, 113-156, 114-152, и 116-147, с которыми могли бы быть ассоциированы наиболее существенные перестройки конформации молекул MHC (Рис. 6).

Это предположение подтверждается тем, что у многих мутантных форм молекул MHC класса I мыши с измененными аллоантигенными свойствами присутствуют аминокислотные замены именно в этих позициях (Табл. 3).
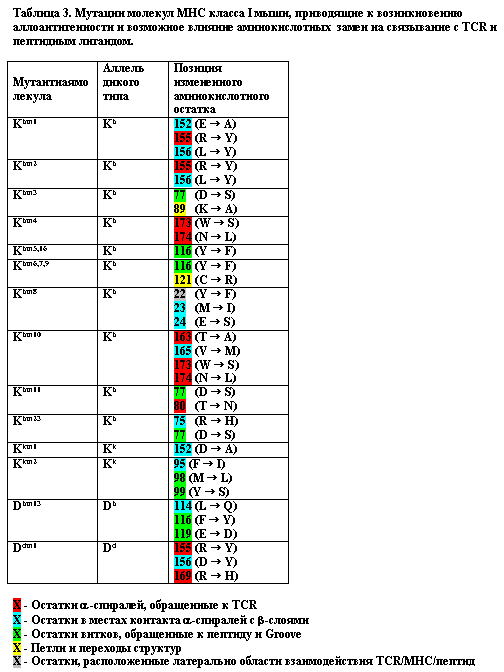
У мутанта bm8 аминокислотные замены находятся в положениях, с малой вероятностью способных воздействовать на связывание с пептидом и TCR, но могут существенно влиять на контакт b-слоя с a-спиралью домена a1. У мутанта Kkm1 имеет место лишь одна аминокислотная замена в остатке 152, контактирующем с b-слоем молекулы. Эти факты свидетельствуют о том, что мутация в области взаимодействия a-спирали c b-слоем может быть достаточным условием для возникновения аллоантигенных свойств у молекулы MHC. Таким образом, приобретение индивидуальных аллоантигенных свойств молекулами MHC класса I может зависеть от вариаций аминокислотных остатков, определяющих внутримолекулярные взаимодействия a-спиралей с b-слоями.
Видовая специфичность в структуре молекул MHC класса I
Пространственная локализация инвариантных остатков молекул MHC класса I млекопитающих, представленных в таблице 1, указывает на то, что они не способны к взаимодействию с Т-клеточными рецепторами. Таким образом, осталась неясной природа консервативных взаимодействий молекул MHC с их естественными лигандами. Весьма выраженный внутривидовой полиморфизм молекул MHC класса I и наличие информации о класс-специфических остатках сделали возможным выявление инвариантных аминокислотных остатков, специфичных для отдельных видов млекопитающих. На рисунке 7 представлены результаты такого анализа, проведенного с использованием последовательностей молекул MHC мыши и человека, - двух видов, наиболее часто исследуемых иммунологами.

На рисунке хорошо видно, что среди аминокислотных остатков, специфичных для вида, присутствуют остатки, способные к взаимодействию с TCR (на рисунке выделены красным цветом). Наибольшее их число присутствует в a2-домене молекул обоих видов. Таким образом, последовательность a-спирали a2-домена является наиболее вероятным кандидатом на формирование эпитопов, участвующих в консервативных взаимодействиях с рецепторами Т-клеток.
Оценка соответствия первичной структуры неклассических молекул MHC класса I мотиву, выявленному у классических
Неклассические молекулы MHC класса I, имеющие существенную гомологию с классическими, в значительной мере лишены их ключевых свойств. Они неспособны к эффективной селекции Т-клеток в тимусе и к эффективной активации Т-клеток. Имеются лишь отдельные сообщения об их способности презентировать антигенные пептиды и быть мишенями для распознавания Т-клетками [9, 10]. В свете полученных данных о мотивах в первичной структуре классических молекул MHC было важно определить, какие именно черты первичной структуры неклассических молекул делают их нефункциональными. Для этого были применены два взаимодополняющих подхода. Первый заключался в поиске аминокислотных замен в позициях, в которых в классических молекулах MHC находятся инвариантные остатки. Второй - в определении всего спектра "запрещенных" аминокислотных замен неклассических молекул MHC - т. е. тех замен, которые не встречаются в классических молекулах MHC (Табл. 4). (Табл. 4).
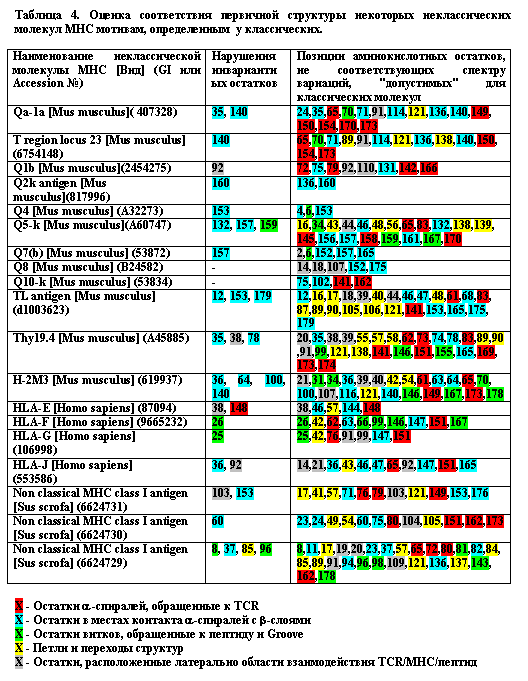
Использование первого подхода, хотя и не давало однозначного ответа на вопрос о критичности замен инвариантных остатков для функции молекул MHC, привело к четкому и определенному результату - в первичной структуре почти всех 37 проанализированных неклассических молекул MHC присутствует от одной до четырех замен в позициях, занимаемых в классических молекулах MHC инвариантными аминокислотными остатками. Таким образом, есть основания полагать, что дефекты в функционировании неклассических молекул MHC класса I связаны с наличием в их первичной структуре аминокислотных замен, критически важных для поддержания канонической структуры. Однако, использование второго подхода дополнительно обнаружило множество других "запрещенных" аминокислотных замен в структуре неклассических молекул MHC, что также могло бы быть причиной нефункциональности молекул этого типа. Многие из таких замен многократно встречаются в гомологичных позициях у различных представителей неклассических молекул MHC. Чтобы выяснить, насколько случайный характер имеют нарушения в неклассических молекулах MHC и как они могут быть связаны с их функциями, все аминокислотные остатки первых двух доменов молекулы были подразделены на пять групп. Первую группу составили 28 остатков, обращенных в область взаимодействия с TCR. Вторую - 56 остатков в местах контакта a-спиралей и b-слоев. Третью - 31 остаток a-спиралей и b-слоев, обращенный в область взаимодействия с пептидом. В четвертую группу вошли 40 остатков, локализованных в "петлях" и местах перехода b-складок друг в друга и в a-спиральные структуры. В пятую - 27 остатков с неясной функцией, локализованные латерально от области взаимодействия как с TCR, так и с пептидом. Для каждой из этих групп остатков была подсчитана частота встречаемости отклонений от выявленного мотива классических молекул MHC в соответствии с формулой P = a/(b x c), где a - общее количество отклонений, обнаруженных среди остатков данной группы, b - количество остатков молекулы, входящих в эту группу, и c - количество исследованных вариантов молекул. Для сравнения подобные вычисления были проведены для дополнительной независимой группы классических молекул MHC, состоящей из 58 аллельных вариантов различных видов млекопитающих. Результаты представлены в таблице 5.
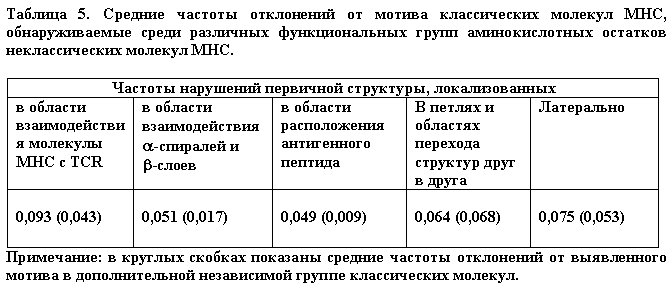
Как видно из таблицы, различия между функциональными группами остатков неклассических молекул в частоте появления "запрещенных" замен невелики - эти частоты отличаются друг от друга не более, чем в 2 раза. Напротив, у классических молекул эти различия значительно более выражены и частоты могут различаться в 5-7 раз. Наиболее четкие различия между классическими и неклассическими молекулами в частоте появления "запрещенных" замен обнаруживаются среди остатков, обращенных к пептиду - частота встречаемости таких замен у неклассических молекул примерно в 5 раз выше, чем у классических. Среди остатков, локализованных в областях контакта b-слоев с a-спиралями неклассических молекул эта частота выше в 3 раза. Среди остатков, обращенных к TCR, частота нарушений у неклассических молекул более, чем в 2 раза выше, чем у классических. В то же время, среди остатков, расположенных латерально от области взаимодействия с TCR, а также в областях перехода структур друг в друга такие частоты существенно не различаются. Этот момент представляется чрезвычайно важным, поскольку может отражать диверсификацию этих двух групп молекул в эволюции, связанную с различиями в их функциях. Ввиду слабо выраженных функциональных свойств неклассических молекул MHC можно было бы предположить, что их структура в значительно меньшей мере подвержена давлению отбора, чем структура классических молекул MHC класса I. Формирование классических молекул MHC должно было решить сразу несколько задач - приобретение способности к связыванию и презентации пептидов и способности к взаимодействию с рецепторами Т-клеток. По всей видимости, именно с решением этих задач связаны обнаруженные различия в строгости соответствия последовательностей молекул этих двух групп мотивам классических молекул MHC. Представляется вполне логичным, что приобретение дополнительных функций классическими молекулами MHC потребовало и дополнительных структурных ограничений для ее реализации. Поэтому становится очевидным, что наряду с "запрещенными" заменами инвариантных аминокислотных остатков, ведущими к драматическим нарушениям структуры и функций, дополнительными факторами "нефункциональности" неклассических молекул MHC, вполне могут быть несоответствия мотивам, определяющим как способность к связыванию с пептидами, так и к прямым взаимодействиям с рецепторами Т-клеток. Результаты, приведенные в таблице 5, позволяют сделать еще одно очень интересное наблюдение, касающееся независимой группы классических молекул MHC, состоящей из 58 аллельных вариантов, о которой говорилось выше. Нетрудно заметить, что частоты встречаемости отклонений от выявленного мотива (показаны в круглых скобках) сильно различаются у разных функциональных групп остатков. В частности, частота отклонений от мотива у остатков, взаимодействующих с TCR (0,043), в 2,5 раза превышает частоту отклонений среди остатков, формирующих внутримолекулярные взаимодействия (0,017) и почти в 5 раз превышает частоту отклонений среди остатков, взаимодействующих с пептидом (0,009). Это наблюдение может свидетельствовать о том, что молекулярная эволюция антигенсвязывающей области молекул MHC исчерпала возможные варианты аминокислотных замен и поэтому выявленный мотив наилучшим образом описывает разнообразие остатков именно этой группы. Среди остатков, взаимодействующих с TCR, частота встречаемости отклонений от мотива, напротив, достаточно велика и существенно не отличается от частот нарушений, обнаруживаемых среди остатков с менее очевидными функциями (приведенных в четвертой и пятой колонках таблицы). Эта особенность может свидетельствовать о продолжающейся эволюции "интерфейса" молекул, непосредственно обращенного к рецепторам Т-клеток.
Использование мотива, выявленного для молекул MHC класса I, для оценки сходства с молекулами MHC класса II
Продукты двух основных классов молекул MHC - молекул класса I и класса II - почти не обнаруживают сходства в первичной структуре. Некоторая гомология существует между последовательностями b-цепей молекул MHC класса II и a2-домена молекул MHC класса I (25-27%), а также между фрагментом a-цепи молекул MHC класса II и b2-микроглобулином (30-35%). Углубление существующих знаний о механизмах реаранжировки генов Т-клеточных рецепторов не привело к обнаружению каких-либо особенностей, влияющих на то, какой класс молекул MHC они будут распознавать. Поэтому очевидно явное несоответствие между единым принципом организации Т-клеточных рецепторов и существенными различиями в структуре распознаваемых ими лигандов. Обнаружение единого мотива в структуре молекул MHC класса I плацентарных млекопитающих давало возможность оценить более тонкое сходство их первичной структуры со структурой молекул MHC класса II, учитывающее спектр аминокислотных замен, которые могут присутствовать в каждой позиции. Сопоставление гомологичных участков b-цепей молекул MHC класса II и a2-домена молекул MHC класса I привело к обнаружению фрагмента AA63-73 Ab-цепей и AA69-79 Eb-цепей, в котором имеет место высокая степень соответствия мотиву, выявленному в участке AA154-164 молекул MHC класса I. Как видно на рисунке 8, в двух аллельных формах молекул MHC класса II мыши - Abk и Ebq - 9 аминокислотных остатков из 11 могут быть обнаружены в соответствующих позициях молекул MHC класса I плацентарных млекопитающих.

По всей видимости, такая "комбинационная гомология" не является случайной, так как на пространственных моделях этих аллельных форм молекул MHC выявленный участок перекрывает область излома альфа-спиральной структуры (так называемый "kink region"), присутствующий в полипептидных цепях обоих типов молекул (Рис. 9).
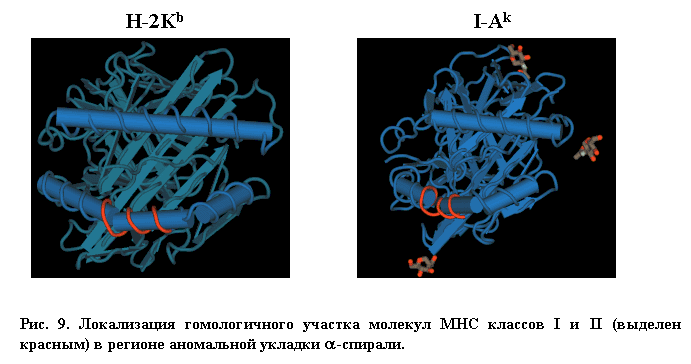
Более того, пространственная локализация индивидуальных аминокислотных остатков этого региона в, казалось бы, совершенно разных по первичной структуре молекулах, тоже совпадает. Это наблюдение представляет значительный интерес потому, что может иметь важное значение для понимания механизмов взаимодействия обоих классов молекул MHC с TCR. В работе Lawren C. Wu из группы Mark M. Davis, опубликованной в Nature в 2002 году, вклад отдельных аминокислотных остатков молекулы MHC класса II Eq во взаимодействие с TCR исследовали методом аланинового мутагенеза [11]. Это исследование позволило выявить фрагмент AA64-73 b-цепи, наиболее сильно влияющий на стабильность связывания молекулы MHC с TCR, что дало основание авторам предположить его "якорную" функцию в узнавании молекулы MHC Т-клеточным рецептором. Нетрудно заметить, что этот фрагмент частично перекрывается с обнаруженным нами участком наибольшего сходства молекул обоих классов MHC. Таким образом, есть основания полагать, что выявленный нами участок может формировать консервативный эпитоп, служащий своего рода "якорем", который позволяет Т-клеточному рецептору "увидеть", что перед ним - молекула MHC.
ЗАКЛЮЧЕНИЕ
В данной работе нами была предпринята попытка определить, может ли огромное разнообразие аллельных форм молекул MHC класса I млекопитающих быть описано в виде единой "формулы", содержащей информацию о мотивах в их первичной структуре. Очевидно, что данную попытку можно считать успешной в отношении молекул MHC класса I плацентарных млекопитающих. В структуре доменов, играющих важную роль в распознавании рецепторами Т-клеток, удалось обнаружить позиции аминокислотных остатков, которые неизменны даже у видов, весьма отдаленных друг от друга в эволюционном отношении. Пространственное расположение инвариантных остатков в третичной структуре молекул MHC свидетельствует об их структурообразующей функции - как правило, они локализованы в местах контакта a-спиралей с b-слоями. Вместе с тем, в местах контакта a-спиралей с b-слоями или в непосредственной близости от них обнаруживаются также пары взаимодействующих вариабельных аминокислотных остатков, формирующих в "жестком каркасе" молекул MHC своего рода "шарнирные области", которые, вероятно, оказывают наиболее существенное влияние на их третичную структуру и могут участвовать в формировании аллоантигенных свойств молекул MHC. Наличие мотива в структуре этих молекул позволило сравнить их с неклассическими молекулами MHC класса I и увидеть следы эволюции различных функциональных групп аминокислотных остатков. И весьма важно то, что полученный здесь результат не разошелся с общепринятым представлением о том, что главной функцией молекул MHC является презентация антигенов - выявленный мотив с наибольшей точностью описывает именно группу остатков, способных влиять на взаимодействие молекулы MHC с антигенным пептидом. Из этого наблюдения также следует интересный вывод о том, что эволюция, по всей видимости, исчерпала возможные варианты аминокислотных замен, участвующих в построении антигенсвязывающего региона. Вместе с тем, получены также данные, опровергающие существующее представление о том, что наиболее вариабельные остатки локализованы в области связывания с антигенным пептидом. Наибольшая вариабельность отмечается среди остатков, способных влиять на связывание с TCR. Интересный результат был также получен при исследовании сходства в структуре классических молекул MHC классов I и II. Оно позволило обнаружить короткий фрагмент, локализованый в районе аномальной укладки a-спирали в a2-домене молекул MHC класса I и в b-цепях молекул MHC класса II, спектр аминокислотных замен в котором почти полностью совпадает у молекул обоих классов. По всей видимости, этот регион может играть роль "якоря" для взаимодействия с Т-клеточным рецептором. Поскольку мы не обладаем полной информацией о всем возможном разнообразии последовательностей молекул MHC различных видов млекопитающих, полученная картина будет меняться по мере секвенирования их новых форм. Но, учитывая тот факт, что выявленный мотив с высокой степенью точности описывает последовательности классических молекул MHC класса I, не включенные исходно в базу данных для его определения, есть основания надеяться, что ее изменения будут незначительными.
Данная работа поддержана грантами РФФИ (02-04-48686 и 02-04-49042), а также Межведомственной Научно-технической программы "Вакцины нового поколения и медицинские диагностические системы будущего" (01.04/1).
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1. Zerrahn J, Held W, Raulet DH.
The MHC reactivity of the T cell repertoire prior to positive and negative selection.
Cell, 1997, V. 88(5), P.627-636
2. Garcia KC, Degano M, Stanfield RL, Brunmark A, Jackson MR, Peterson PA, Teyton L, Wilson IA.
An alphabeta T cell receptor structure at 2.5 A and its orientation in the TCR-MHC complex.
Science, 1996, V. 274, N 5285, P.209-19.
3. Reiser JB, Darnault C, Guimezanes A, Gregoire C, Mosser T, Schmitt-Verhulst AM, Fontecilla-Camps JC, Malissen B, Housset D, Mazza G.
Crystal structure of a T cell receptor bound to an allogeneic MHC molecule.
Nature Immunology, 2000, V. 1, N 4, P. 291-297.
4. Manning TC, Schlueter CJ, Brodnicki TC, Parke EA, Speir JA, Garcia KC, Teyton L, Wilson IA, Kranz DM.
Alanine scanning mutagenesis of an alphabeta T cell receptor: mapping the energy of antigen recognition.
Immunity, 1998, V. 8, P. 413-425.
5. Sun R, Shepherd SE, Geier SS, Thomson CT, Sheil JM, Nathenson SG.
Evidence that the antigen receptors of cytotoxic T lymphocytes interact with a common recognition pattern on the H-2Kb molecule.
Immunity, 1995, V. 3, N 5, P. 573-582.
6. Kazanskii DB, Chernysheva AD, Sernova NV, Petrishchev VN, Pobezinskii LA, Agafonova EL, Chervonskii AV.
The nature of epitopes, recognized by T-lymphocytes in the allogenic immune response.
Mol. Biol. (Mosk), 1998, V. 32(4), P. 692-702.
7. Auchincloss HJr, Sachs DH. Xenogeneic transplantation. Annu. Rev. Immunol., 1998, V.16, P. 433-470.
8. Janeway CAJr, Travers P, Walport M, Shlomchik MJ.
Antigen presentation to T lymphocytes.
Immunobiology. The immune system in health and disease. 5th edition. Garland Publishing, NY, 2001, P. 155-184.
9. Jiang H, Chess L.
The specific regulation of immune responses by CD8+ T cells restricted by the MHC class Ib molecule, Qa-1.
Annu. Rev. Immunol., 2000, V. 18, P. 185-216.
10. Nataraj C, Huffman GR, Kurlander RJ.
H2M3wt-restricted, Listeria monocytogenes-immune CD8 T cells respond to multiple formylated peptides and to a variety of gram-positive and gram-negative bacteria.
Int Immunol., 1998, V. 10(1), P. 7-15.
11. Wu LC, Tuot DS, Lyons DS, Garcia KC, Davis MM.
Two step binding mechanism for T cell receptor recognition of peptide-MHC.
Nature, 2002, V. 418, P. 552-556.
![]()