ПРЯМОЕ РАСПОЗНАВАНИЕ АЛЛОАНТИГЕНА КЛЕТКАМИ ПАМЯТИ CD8+,
ПОЛУЧЕННЫМИ В ОТВЕТЕ НА ИММУНИЗАЦИЮ КЛЕТКАМИ АЛЛОГЕННОЙ ОПУХОЛИ
Е.Л.Побезинская1, Л.А.Побезинский1, В.Н.Петрищев,
Т.С.Терещенко, Т.В.Анфалова, Л.М.Хромых,
Д.Б.Казанский*
Российский Онкологический Научный Центр им. Н.Н.Блохина РАМН, г. Москва
РЕЗЮМЕ
Иммунизация мышей B10.D2 (R101) (KdIdDb) клетками тимомы EL4 и саркомы
MC-11 (KbDb) приводит к эффективной индукции
цитотоксических Т-лимфоцитов (CTL), специфичных к аллоантигену H-2Kb опухолевых клеток. Ранее мы показали, что в течение
нескольких месяцев после иммунизации в селезенке и в печени иммунных животных содержатся Т-клетки памяти, способные
пролиферировать и дифференцироваться в эффекторные CTL в ответе на тот же аллоантиген антигенпрезентирующих клеток (АПК),
убитых острым тепловым шоком (45oC, 1 ч) или химической фиксацией. В этой работе мы использовали
ряд независимых подходов,
нацеленных на выяснение механизма распознавания аллоантигена рецепторами клеток памяти. Результаты исследования
поликлональных популяций клеток памяти, полученных ex vivo, популяций клеток памяти, обогащенных в ответе на прогретые
аллогенные клетки in vitro, а также клонов и Т-гибридом клеток памяти однозначно свидетельствуют о том, что в ответе на
аллоантиген H-2Kb пролиферируют предшественники вторичных эффекторных CTL, распознающие аллоантиген в соответствии
с механизмом прямого аллогенного распознавания. Т-клетки памяти способны получить антигенспецифический сигнал от
функционально инертных АПК, но для успешного развития пролиферативного ответа им необходим костимулирующий сигнал
профессиональных АПК, в присутствии которых клетки памяти пролиферируют, несмотря на экспрессию ими мРНК супрессорных
цитокинов IL-10 и TGFb. Костимуляторный сигнал профессиональных АПК может быть полностью замещен экзогенным IL-2.
Анализ ответов ряда Т-клеточных гибридом клеток памяти показал, что способность части клонов к ответу на прогретые
аллогенные клетки ассоциирована с их способностью к кросс-реакциям с мутантными формами молекулы H-2Kb и с неспособностью
антител к аллоантигену H-2Kb полностью подавить ответ таких клонов на интактные аллогенные стимуляторы, что свидетельствует
о необычайно высокой аффинности рецепторов части клонов клеток памяти. Эти результаты указывают на неполную корректность
использования моделей с трансгенными Т-клеточными рецепторами для анализа феномена иммунологической памяти.
Очевидно, что этот анализ не должен ограничиваться исследованиями особенностей лишь фенотипа и активационного аппарата
клеток памяти, а должен вовлекать исследования особенностей организации их Т-клеточных рецепторов, а также механизмов
их периферической селекции. Полученные результаты дают альтернативное общепринятому объяснение тому, как иммунная система
может распознавать и устранять вирусинфицированные и трансформированные клетки организма, не являющиеся
профессиональными АПК.
Ключевые слова: иммунологическая память, Т-лимфоцит, пролиферация, иммунология, клонирование, аллоантиген, гибридома
Принятые сокращения: MHC - major histocompatibility complex - главный комплекс гистосовместимости, MLR - mixed
lymphocyte reaction - реакция смешанной культуры лимфоцитов, MLTC - mixed lymphocyte tumor culture - смешанная
культура лимфоцитов и опухолевых клеток, TCR - T cell receptor - Т-клеточный рецептор,
АПК - антигенпрезентирующая клетка, TAP - transport associated proteins - белки, ассоциированные с транспортом пептидов
в эндоплазматический ретикулум.
*- автор для переписки: 115478, г. Москва, Каширское шоссе 24, НИИ канцерогенеза РОНЦ РАМН,
Лаб. Механизмов регуляции иммунитета.
E-mail: kazansky@dataforce.net
1 - авторы внесли одинаковый вклад в создание этой статьи
ВВЕДЕНИЕ
В течение многих лет известно, что дифференцировка наивных Т-лимфоцитов в эффекторные цитотоксические Т-лимфоциты (CTL)
требует нескольких циклов пролиферации в ответе на жизнеспособную антигенпрезентирующую клетку (АПК),
несущую антигенный пептид в связывающей "бороздке" молекулы MHC класса I. Облучение или необратимая блокада
синтеза ДНК в АПК не оказывают существенного влияния на их способность индуцировать CTL. Вместе с тем, ряд иных
воздействий на АПК, включая тепловой шок, обработку ультразвуком, замораживание-оттаивание, фиксацию или облучение
ультрафиолетом, приводит к исчезновению пролиферативных ответов Т-клеток и их дифференцировки в эффекторные CTL [1-4].
После иммунизации мышей клетками аллогенных опухолей на 10-й день наблюдается пик активности первичных эффекторных CTL,
эффективно уничтожающих клетки опухоли [5]. Затем цитолитическая активность аллоспецифических CTL падает и окончательно
исчезает через 1-1,5 месяца после иммунизации [6]. Через 2-4 месяца после иммунизации в селезенке мышей присутствуют
иммунные клетки, способные к дифференцировке в CTL без синтеза ДНК после стимуляции прогретыми, облученными ультрафиолетом
или фиксированными АПК, фрагментами аллогенных клеток или Т-клеточными митогенами [7-11].
В отличие от наивных клеток, требующих 6-7 дней культивирования в MLR in vitro для приобретения специфической
цитолитической активности, иммунные клетки приобретают ее значительно быстрее, всего лишь за сутки, демонстрируя,
таким образом, ключевое свойство долгоживущих клеток памяти. Недавно мы обнаружили, что такая дифференцировка
сопровождается пролиферацией Т-лимфоцитов, что позволяло нам надеяться на возможность четкого функционального
разделения наивных клеток и клеток памяти, не основанного на различиях их поверхностных маркеров [12].
В этой работе мы описываем фенотип, специфичность, и условия активации Т-клеток, пролиферирующих в ответ на молекулу
H-2Kb, представленную на поверхности аллогенных АПК, подвергнутых острому тепловому шоку. Используя
рестимуляции прогретыми аллогенными клетками, мы обнаружили селективную пролиферацию клеток CD8+,
которые распознают молекулу H-2Kb в соответствии с механизмом прямого аллогенного распознавания.
Эта пролиферация требует либо костимуляторных сигналов от живой "посторонней" АПК либо экзогенного IL-2.
Все полученные нами клоны пролиферирующих клеток памяти были цитолитическими и убивали аллогенные мишени,
экспрессирующие молекулу H-2Kb. Анализ репертуара клеток памяти с использованием Т-гибридом подтвердил
прямой механизм распознавания аллоантигена клетками памяти, показал ассоциацию их способности реагировать на прогретые
клетки с высокой аффинностью TCR и указал на существование заметной доли клонов с гетероклитическими свойствами
в популяции клеток памяти.
УСЛОВИЯ ЭКСПЕРИМЕНТА
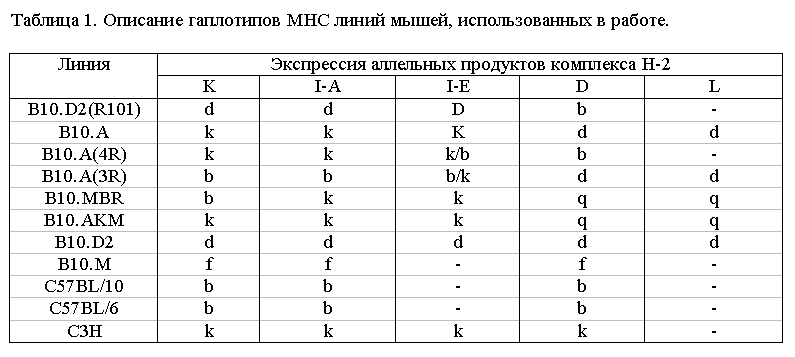
Лабораторные животные. В работе использованы мыши инбредных линий, описанные в таблице 1,
полученные из вивария Российского Онкологического Научного Центра РАМН и нокауты C57BL/6J-B2mtm1Unc
по молекуле b2-микроглобулина и C57BL/6J-Tap1tm1Arp по молекуле
TAP-1 мышей C57BL/6 полученные из Jackson Laboratory (Bar Harbor, Main, USA) и поддерживаемые в spf-условиях
в нашей лаборатории.
Приготовление клеточных суспензий. Стимулирующие (стимуляторы) и отвечающие лимфоциты (респондеры)
выделяли из селезенок мышей в гомогенизаторе Поттера с коническим пестиком осторожным выдавливанием из стромы органа.
Полученные клетки трижды отмывали центрифугированием (200G, 7 мин) в среде Игла
(Институт полиомиелита и вирусных энцефалитов, Москва) с добавлением 10% прогретой (56оС, 30 мин)
сыворотки крупного рогатого скота (производства Киевского мясокомбината). Жизнеспособные клетки подсчитывали
в смеси трипанового синего и эозина.
Обработка стимулирующих клеток. Для использования в качестве стимулирующих клеток в MLR или для
рестимуляций линий и клонов Т-клеток спленоциты мышей подвергали g-излучению от
источника 137Cs в дозе 25 Гр либо обработке митомицином С (25 мкг/мл, 37oC, 30 мин ).
В ряде экспериментов использовали популяции обогащенных профессиональных АПК. Для их получения облученные
спленоциты в полной среде помещали в культуральные полистиреновые плоскодонные планшеты из расчета 5 х 104
мононуклеаров селезенки на 1 мм2 поверхности пластика и инкубировали в течение 2 ч. После этого
неприкрепившиеся к пластику клетки удаляли 3-кратной отмывкой средой, подогретой до 37oC.
Прогревание стимулирующих клеток проводили в водяной бане, поддерживающей температуру с точностью 0.2оС.
Острый тепловой шок индуцировали инкубацией при 45оС в течение 60 мин. После такой обработки
клетки не окрашивались трипановым синим в течение нескольких часов, затем наблюдался рост числа клеток с нарушенной
проницаемостью мембран, ускоренный по сравнению с необработанными клетками. Измерения катаболизма MTT [13] и включения
[3H]-тимидина показали, что через сутки эти клетки являются метаболически неактивными. Фиксацию стимулирующих
клеток осуществляли в 0.1% растворе параформальдегида (Sigma) в растворе Хенкса в течение 30 мин, после чего клетки
отмывали от параформальдегида не менее пяти раз.
Реакция MLR. Для постановки первичной MLR 3 х 105 спленоцитов мышей B10.D2(R101)
инкубировали в присутствии аллогенных и сингенных стимуляторов в полной среде: RPMI-1640, cодержащей 5%
сыворотки человека, 0.016% гентамицина сульфата (Производственное объединение "Мосхимфарпрепараты"),
4 ммоль L-глутамина (Serva), 20 ммоль HEPES (Sigma) и 5 х 10-5 М 2-меркаптоэтанола (Merck)
при различных соотношениях респондеров и стимуляторов при 37оС в атмосфере с 5% CO2
и абсолютной влажностью. Культуру MLTC готовили сходным образом, используя метод [14] с незначительными вариациями.
Для постановки вторичной MLR клетки памяти обогащали в первичной MLR с прогретыми аллогенными стимуляторами
в течение 10 дней, собирали, очищали от погибших клеток центрифугированием на ступенчатом градиенте плотности
фиколла-верографина с плотностью 1.09 и затем в количествах от 6-48 х 103 помещали в лунки
плоскодонных 96-луночных планшет, содержащие 2 х 106 облученных либо прогретых стимуляторов
в присутствии либо в отсутствии облученных спленоцитов, прилипающих к пластику и/или 10 МЕ/мл мышиного IL-2.
Через 4 суток инкубации интенсивность пролиферации (CPM) определяли по включению [3H]-тимидина
в течение 18 ч. Аллогенный ответ подсчитывали как разность между включением [3H]-тимидина
в культуры с аллогенными и сингенными стимуляторами.
Антитела. Для описания состава клеточных популяций методом FACScan использовали следующие антитела
к поверхностным антигенам лимфоцитов мыши: меченные изотиоцианатом флуоресцеина (FITC) анти-CD8,
(Clone 53-6.7), а также меченные фикоэритрином (PE) анти-CD4 фирмы Pharmingen (USA). Антитела к мышиному
ICAM-1 (Clone YN1/1.7.4), CD44H (Clone KM201) и CD3 (Clone 145-2C11) использовали в виде супернатантов гибридом
(гибридомы любезно предоставлены профессором А. В. Червонским (Jackson Laboratory, Bar Harbor, Main, USA).
Клеточные линии. Клетки тимомы EL4 (KbDb) и саркомы MC-11 (KbDb) получали в асцитной форме, пассируя их в сингенных мышах С57BL/6 и C57BL/10 соответственно. Клетки тимомы
BW5147 (KkDk) от мышей AKR пассировали in vitro в среде RPMI-1640 с добавлением 4 ммоль
L-глутамина и 10% эмбриональной телячьей сыворотки. В тех же условиях культивировали линии трансформированных
мышиных фибробластов bm1SV (Kbm1Db), bm3SV (Kbm3Db) ,
C57SV (H-2b), BRSV (H-2k), D2SV (H-2d), MSV (H-2f), SSV (H-2s).
Иммунизацию мышей R101 проводили внутрибрюшинной инъекцией каждому животному 2.5 x 107
опухолевых клеток тимомы EL4 или саркомы MC-11. Через 2 месяца после иммунизации спленоциты таких мышей использовали
в экспериментах как источник клеток памяти, специфичных к молекуле Kb. Как источник мышиного IL-2
использовали линию EL4, с высокой спонтанной продукцией этого цитокина (линия любезно предоставлена профессором
А. В. Червонским (Jackson Laboratory, Bar Harbor, Main, USA). Линию поддерживали в среде DMEM с добавлением
4 мМ L-глутамина и 10% эмбриональной телячьей сыворотки. Для определения концентрации IL-2 использовали тест,
основанный на измерении катаболизма МТТ клетками IL-2-зависимой линии CTLL-2 с незначительными модификациями [15].
Как правило, концентрация IL-2 в супернатанте составляла не менее 1000 МЕ/мл. Линию CTLL-2 поддерживали в
среде RPMI-1640 с добавлением 4 ммоль L-глутамина, 10% эмбриональной телячьей сыворотки и 5 МЕ/мл IL-2.
Линию BWZ.36 CD8 alpha (трансфектант линии BW5147, содержащий конструкты генов CD8a и LacZ-оперон, находящийся
под контролем NF-AT-индуцибельного промотора) использовали с любезного разрешения доктора N. Shastri
(Department of Molecular and Cell Biology, University of California, Berkeley 94720-3200, USA) и поддерживали
в среде RPMI-1640 с добавлением 4 ммоль L-глутамина и 10% эмбриональной телячьей сыворотки [16]. Линии и клоны
клеток памяти получали методом лимитирующих разведений популяции клеток памяти, обогащенной в течение 10 дней
в MLR с прогретыми стимуляторами. Рестимуляции в присутствии 10 МЕ/мл экзогенного IL-2 проводили облученными
либо прогретыми аллогенными спленоцитами каждые 10 дней. Цитолитическую активность против тимом EL4, BW5147 и
мастоцитомы P815 определяли, используя модификацию теста Винна in vitro с МТТ [17].
Получение и тестирование специфичности Т-клеточных гибридом. Т клетки памяти, обогащённые в ответе
на прогретые стимуляторы в течение 4 дней, и клетки BWZ.36 отмывали два раза в среде без сыворотки.
Затем смешивали в соотношении 3:1 в плоскодонных стеклянных флаконах, центрифугировали 4 мин. 1500 g и
инкубировали 20 мин. при 37оС в СО2-инкубаторе. После этого удаляли супернатант и
добавляли 50% раствор полиэтиленгликоля PEG-1500 (Merck) в 75 мМ HEPES, pH 7,0, предварительно нагретый
до 37оС, на 70 секунд. Затем три раза отмывали средой без сыворотки по 2 мин. при 1000 g.
После последней отмывки добавляли 20 мл среды с сывороткой и инкубировали 45 мин при 37оС в
СО2-инкубаторе. Затем клетки подсчитывали и суспензию помещали в 96-луночные плашки в концентрации
0.4 млн/мл. Через 2 суток среду в лунках замещали селективной средой, содержащей HAT, а через 2 недели
выросшие клоны переводили в селективную среду, содержащую HA. Тестирование Т-клеточных гибридом проводили,
помещая гибридомные клетки в лунки плоскодонных планшет, содержащие АПК, экспрессирующие различные аллельные
формы MHC. Через сутки планшеты замораживали и впоследствии тестировали супернатанты по способности поддерживать
рост и жизнеспособность клеток линии CTLL-2 [15].
RT-PCR. Для определения экспрессии генов костимуляторов и цитокинов суммарную РНК экстрагировали
из культивируемых клеток в количестве 6 x 105 общепринятым методом [18] с небольшими модификациями.
Выделенную РНК растворяли в деионизованной воде. Для защиты от РНКаз в раствор РНК вносили RNAzine (Promega)
в количестве 80 ед. на 100 мкл. Первую цепь кДНК синтезировали, используя Superscript (Life Technologies, USA)
и d(T)15 праймеры согласно протоколу, рекомендуемому производителем. После проведения обратной
транскрипции в пробирку добавляли 40 мкл смеси для PCR, содержащей 67 ммоль Трис-HCl, pH 8.8 (при 25оС),
16.6 ммоль (NH4)2SO4, 3,5 ммоль MgCl2, по 200 пмоль каждого dNTP
и по 20 пмоль каждого из праймеров. Структура праймеров, использованных для RT-PCR, приведена в таблице 2.
Проводили 30-37 циклов PCR со следующими режимами: 94оС 45 с, 56-58оС 45 с, 73оС 90 с.
После завершения PCR 10 мкл реакционной смеси наносили на 2% гель агарозы, содержащий бромистый этидий и
разделяли электрофорезом в Трис-боратном буфере в режиме 8 В/см в течение 45 мин. Гели фотографировали и
анализировали, используя УФ-трансиллюминатор. Результатат считали положительным, если после 30 циклов можно
было наблюдать образование видимой электрофоретической полосы амплифицированного продукта и отрицательным,
если продукт не обнаруживался после 37 циклов.
Таблица 2. Структура праймеров, использованных в работе и размеры амплифицируемых продуктов
| Название
|
Структура праймеров
|
Размер продукта
амплификации,
оснований
|
| GAPD
|
AS 5'-CTCAGTGTAGCCCAGGATGC-3'
S 5'- ACCACCATGGAGAAGGCTGG-3'
|
528
|
| IL-2
|
AS 5'-TGATGAAATTCTCAGCATCTTCCA-3'
S 5'-GACACTTGTGCTCCTRGTCAACAG-3'
|
329
|
| IL-4
|
AS 5'-TGCATGATGCTCTTTAGGCTTTCC-3'
S 5'- AGATCATCGGCATTTTGAACGAGGTC-3'
|
313
|
| IL-10
|
AS 5'-AAAATCACTCTTCACCTGCTCCAC-3'
S 5'-GGACAACATACTGCTAACCGACTC-3'
|
256
|
| IFNg
|
AS 5'-GGACAATCTCTTCCCCACCCCGAA-3'
S 5'-AGCTCTGAGACAATGAACGCTACA-3'
|
504
|
| TGFb1
|
AS 5'-ATCCACTTCCAACCCAGGTCCTT-3'
S 5'-AGGAGACGGAATACAGGGCTTTCG-3'
|
303
|
| TNFa
|
AS 5'-GCTGAGTTGGTCCCCCTTCTCCAG-3'
S 5'-AGTGGTGCCAGCCGATGGGTTGT-3'
|
252
|
| FasL
|
AS 5'-TCCTCCATTAGCACCAGATCC-3'
S 5'-AGAAGGAACTGGCAGAACTCC-3'
|
358
|
| CD40L
|
AS 5'-TGCTTTTCATGGTATAATATC-3'
S 5'-CTGTGTATCTTCATAGAAGATTGG-3'
|
321
|
| Bcl-2
|
AS 5'-AATCCAGCTCTTTTATTGGATGT-3'
S 5'-CGATGGTGTGGTTGCCTTATGTA-3'
|
506
|
| CTLA-4
|
AS 5'-CAGTCATTTGGTCATTTGTCTGC-3'
S 5'-TTGTAGCCCTGCTCACTCTTC-3'
|
183
|
| Перфорин
|
AS 5'-CTGTAAAAACTCCCTAATGAGA-3'
S 5'-AGTCAAGGTGGAGTGGAGGTTT-3'
|
353
|
Статистическая обработка. Для каждой экспериментальной группы подсчитывали среднее арифметическое
и среднюю ошибку выборки. Статистическую обработку проводили с использованием t-критерия Стьюдента.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Определение фенотипа клеток, пролиферирующих в ответе на стимуляторы, подвергнутые тепловому шоку.
Ранее мы показали, что спектры условий активации наивных Т-клеток и Т-клеток памяти существенно различаются.
Одно из наиболее четких различий между этими типами клеток выявляется в их способности отвечать на антиген,
представленный на поверхности функционально инертных АПК в культуре in vitro [12].
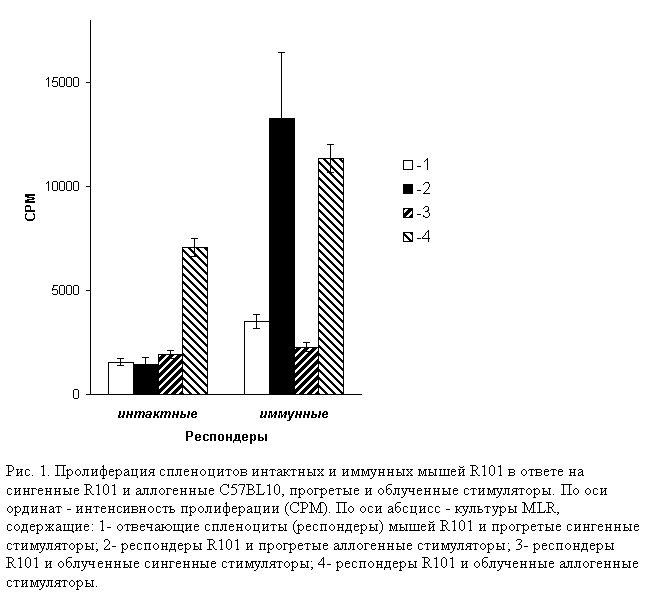
Результаты, представленные
на рисунке 1, показывают, что спленоциты интактных мышей В10.D2(R101) пролиферируют в ответе на облученные,
но не прогретые аллогенные стимуляторы мышей C57BL/6. Напротив, спленоциты, выделенные из животных, предварительно
иммунизированных аллоантигеном H-2Kb, представленным на поверхности клеток тимомы
EL4 (KbDb), активно пролиферируют в ответе как на облученные, так и на прогретые
аллогенные стимуляторы, экспрессирующие тот же аллоантиген.
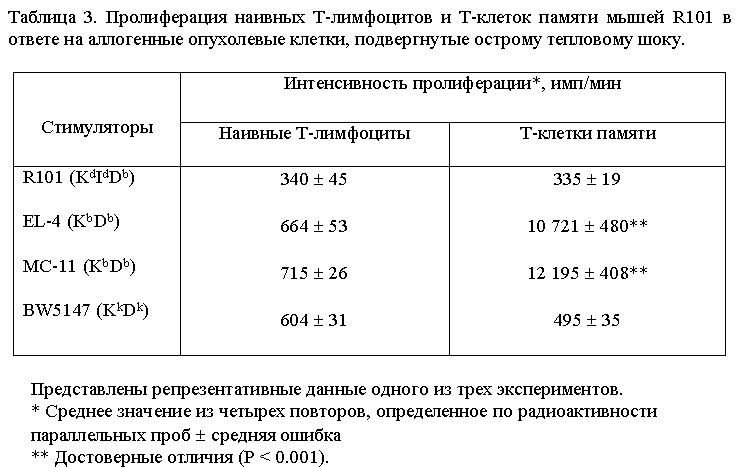
В таблице 3 представлены данные, показывающие
специфичность этого ответа. Спленоциты иммунных животных отвечают пролиферацией на прогретые клетки
тимомы EL4 (KbDb) и саркомы MC-11 (KbDb), экспрессирующие
аллоантиген H-2Kb, использованный для иммунизации, но не отвечают на клетки
тимомы BW5147 (KkDk), экспрессирующие иные аллельные формы молекул гистосовместимости.
Для ответа на вопрос, какие именно типы Т-клеток пролиферируют в ответе на прогретые стимуляторы, мы ставили
MLR клеток селезенки иммунизированных животных с прогретыми стимуляторами мышей R101, C57BL/10 и C3H и на 5-й день извлекали
из культуры жизнеспособные клетки, окрашивали их антителами к CD4 и CD8 и анализировали в проточном
цитофлуориметре.
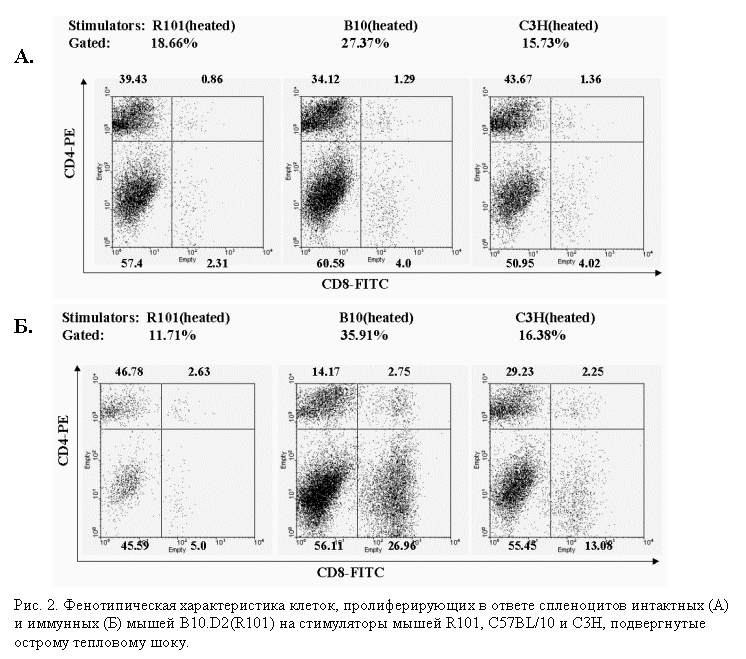
Результаты, представленные на рисунке 2, убедительно свидетельствуют о том, что в ответе
на прогретые аллогенные клетки избирательно пролиферируют лимфоциты CD8+CD4-. Вызывает удивление
тот факт, что мы не обнаружили сколько-нибудь существенной пролиферации
клеток CD4+, обычно являющихся мажорной популяцией клеток, отвечающих в стандартной MLR на облученные
стимуляторы.
Оценка зависимости пролиферации клеток памяти от профессиональных АПК. Прогревание стимулирующих клеток
при температуре 45oC в течение 1 ч ведет к гибели АПК, на которых экспрессирован аллоантиген,
распознаваемый клетками памяти [12]. Одним из наиболее ранних и ярких проявлений ответа на тепловой шок, отмеченных
в литературе, является утрата клеткой способности к перестройке цитоскелета, которая необходима для формирования
стабильного иммунологического синапса между Т-лимфоцитом и АПК в процессе индукции иммунного ответа [19, 20].
Как мы показали ранее, тепловой шок ведет также к глубокому подавлению экспрессии костимулятора B7(CD80) и способности
АПК к костимуляции ответов Т-клеток [12]. Поэтому было важным определить, играют ли какую-либо роль в ответе
профессиональные АПК, содержащиеся в популяции отвечающих клеток, и необходимы ли клетке памяти костимуляторные сигналы
профессиональных АПК. С этой целью суспензии спленоцитов интактных и иммунных животных в полной среде в количестве не
более 2 х 107/мл помещали в пластиковые культуральные флаконы с площадью дна 25 см2 и
помещали в CO2-инкубатор на 2 часа. Неприкрепившиеся клетки, обедненные профессиональными АПК, в дальнейшем
тестировали по их способности к пролиферативному ответу на облученные и прогретые аллогенные стимуляторы в отсутствии и в
присутствии фракции облученных спленоцитов интактных мышей R101, прилипающей к пластику.
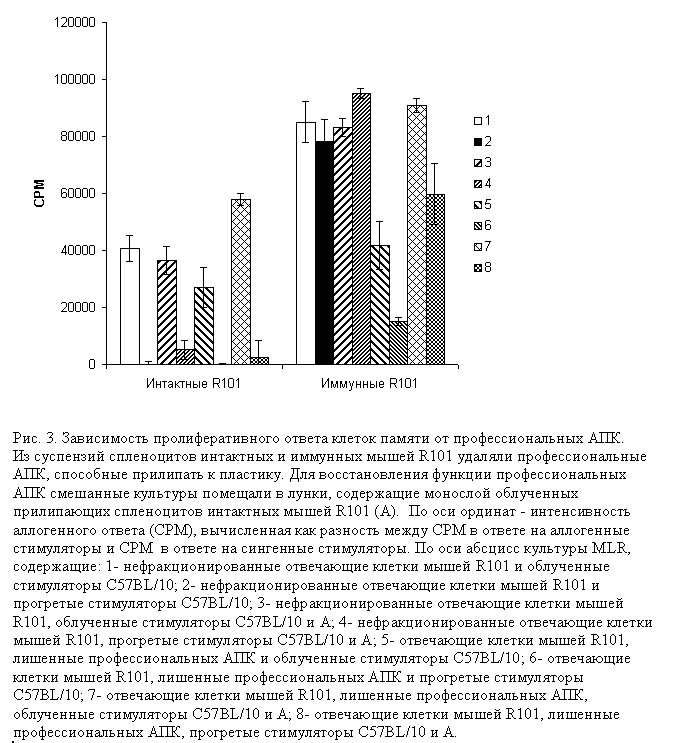
Результаты, представленные
на рисунке 3, однозначно свидетельствуют о необходимости присутствия профессиональных АПК для развития ответов клеток
памяти в ответ на стимуляторы, подвергнутые острому тепловому шоку. Удаление из популяции отвечающих клеток профессиональных
АПК приводит к глубокому подавлению пролиферативного ответа на прогретые аллогенные клетки, но этот ответ восстанавливается
в присутствии облученных АПК из селезенки интактных животных. Второе независимое подтверждение необходимости
присутствия АПК для ответов клеток памяти было получено в системе, основанной на обогащении клеток памяти, отвечающих на
прогретые аллогенные стимуляторы в MLR in vitro. Спленоциты иммунных животных смешивали с прогретыми аллогенными клетками
мышей C57BL/6 и C3H (посторонний стимулятор) и инкубировали в течение 10 дней. После этого жизнеспособные лимфоциты
выделяли на ступенчатом градиенте фиколла-верографина с плотностью 1.09 и тестировали их ответы на облученные и прогретые
стимуляторы мышей C57BL/6 в присутствии и в отсутствии облученных прилипающих клеток селезенки мышей R101, а также на
прогретые и облученные стимуляторы мышей C3H.
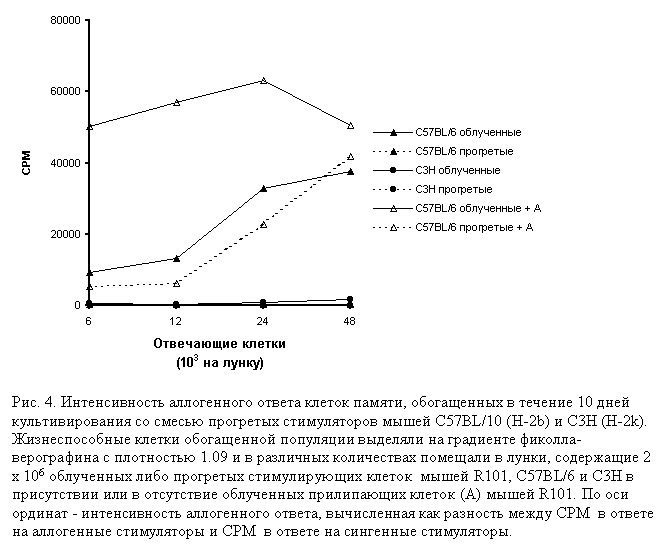
Результаты, представленные на рисунке 4, показывают, что вторичная рестимуляция клеток памяти прогретыми аллогенными клетками невозможна без дополнительного добавления в культуры облученных профессиональных АПК интактных мышей, что говорит об исчезновении либо утрате функциональной полноценности АПК в процессе 10-дневного культивирования клеток. При относительно высокой концентрации отвечающих клеток (4.8 х 103 на лунку) наблюдается выраженная пролиферация клеток памяти, сопоставимая по интенсивности в культурах, рестимулированных облученными аллогенными АПК, а также прогретыми и облученными аллогенными АПК в присутствии прилипающих клеток. При низких концентрациях отвечающих клеток самый высокий пролиферативный ответ развивается в культурах, стимулированных смесью облученных аллогенных клеток и прилипающих сингенных клеток, но это усиление мы наблюдали не во всех экспериментах. Важен тот факт, что популяция клеток памяти, обогащенная в ответе на прогретые аллогенные клетки, без добавления сингенных АПК вполне успешно отвечает на облученные аллогенные стимуляторы, что свидетельствует о возможности прямого распознавания ими аллоантигена как на поверхности прогретой, так и на поверхности облученной аллогенной АПК. Отсутствие какого-либо ответа обогащенной популяции как на прогретые, так и на облученные клетки "посторонней" линии мышей C3H (H-2k) говорит о том, что в ответ клеток памяти, специфичных к H-2Kb, на прогретые стимуляторы не вовлекаются наивные клетки с посторонней специфичностью, что свидетельствует о высокой селективности примененного метода обогащения клеток памяти. С целью выяснения роли костимуляторных лигандов АПК в развитии пролиферативных ответов клеток памяти мы использовали антитела к ранним костимуляторным лигандам ICAM-1 и CD44H [21, 22]. Супернатанты гибридом YN1/1.7.4 и KM201 добавляли в смешанные культуры, содержащие спленоциты иммунных животных и прогретые либо облученные стимуляторы мышей C57BL/6, а также в культуры, содержащие спленоциты интактных животных и облученные аллогенные стимуляторы.
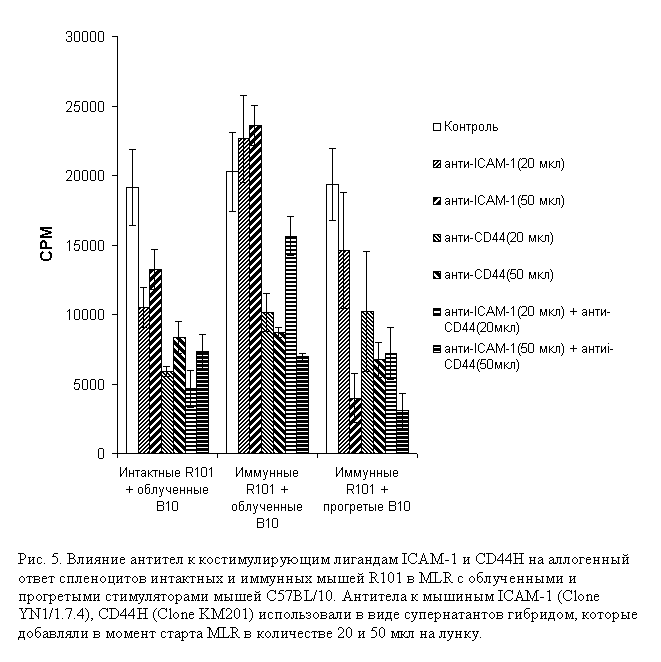
Результаты, представленные на рисунке 5, свидетельствуют о том, что CD44H участвует в индукции ответов как наивных
лимфоцитов, так и клеток памяти, поскольку антитела к нему заметно подавляют пролиферацию. То же самое справедливо
и в отношении лиганда ICAM-1, но ответ клеток памяти на облученные аллогенные стимуляторы не изменяется при
добавлении антител. Таким образом, существуют различия в требовании лиганда ICAM-1 как между наивными клетками и
клетками памяти, отвечающими на облученные аллогенные стимуляторы, так и между клетками памяти, отвечающими на
прогретые и облученные стимуляторы. Эти различия могут свидетельствовать о том, что пролиферативный ответ клеток
памяти в значительно меньшей мере, чем ответ наивных клеток, зависит от формирования организованного иммунологического
синапса между Т-лимфоцитом и АПК, позволяющего оптимальным образом организовать архитектуру проведения
антигенспецифических и костимуляторных сигналов внутрь клетки.
Исследование механизма распознавания аллоантигена клетками памяти. Согласно существующим представлениям,
аллогенное распознавание может осуществляться в соответствии с двумя механизмами. Первый из них - прямое
распознавание - реализуется через прямое взаимодействие рецептора отвечающего Т-лимфоцита с аллогенной молекулой MHC.
Второй - непрямое распознавание - заключается в распознавании пептида аллогенной молекулы, процессированного и
представленного АПК иммунизированного реципиента. Учитывая данные, изложенные выше, в исследуемой системе можно
было ожидать два вероятных "сценария", по которым клетки памяти CD8+ могли бы распознать аллоантиген.
В соответствии с первым из них, рецептор клетки памяти прямо распознает молекулу H-2Kb на поверхности клетки,
убитой прогреванием. Второй сценарий состоял бы в переносе пептидов аллогенной молекулы шаперонами из донорских
АПК, гибнущих апоптозом, в АПК реципиента - явлении, лежащем в основе механизма "кросс-примирования" [23-26]. Поэтому
для правильной интерпретации эффекта было важным четко определить, распознает ли клетка памяти аллоантиген на поверхности
мертвой аллогенной АПК или она распознает аллоантиген в процессированной форме в контексте молекул MHC реципиента
на поверхности АПК, содержащихся в популяции отвечающих клеток. Важная роль костимуляции в развитии ответов клеток
памяти, выявленная в экспериментах, описанных выше, диктовала необходимость исключения этого параметра при
экспериментальной идентификации механизма распознавания аллоантигена. Одним из наиболее эффективных средств для этого
является добавление в тестируемые культуры экзогенного IL-2 [27].
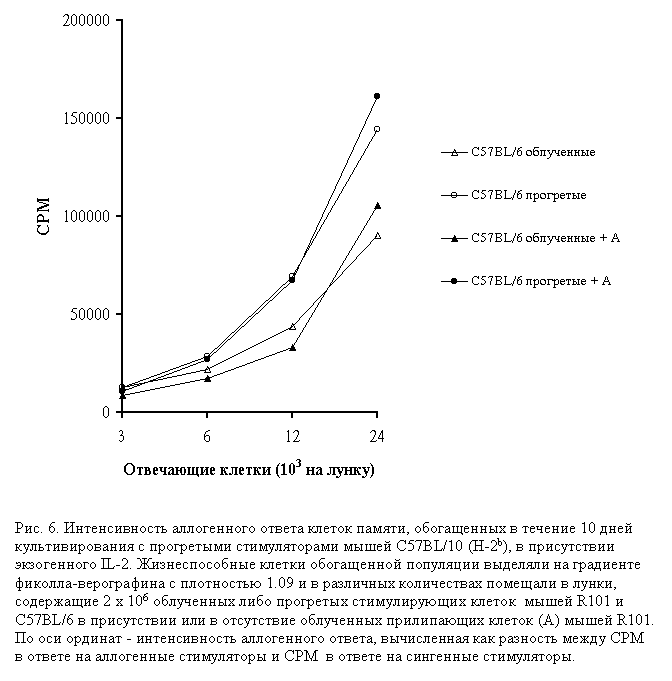
На рисунке 6 представлены данные тестирования специфичности обогащенной популяции клеток памяти в ответах на облученные и прогретые аллогенные стимуляторы в присутствии либо в отсутствии облученных прилипающих к пластику клеток селезенки мышей R101. Как видно на рисунке 6, в присутствии 10 МЕ/мл экзогенного IL-2 ответы клеток памяти разительно отличаются от ответов в его отсутствие, представленных на рисунке 4. Следует отметить, что во-первых, полностью восстанавливается способность клеток памяти отвечать на прогретые аллогеннные стимуляторы без какого-либо добавления экзогенных АПК. Во-вторых, добавление прилипающих клеток селезенки мышей R101 не приводит к какому-либо увеличению интенсивности пролиферативных ответов клеток памяти как на облученные стимуляторы, так и на прогретые. Таким образом, добавление экзогенного IL-2 позволяет полностью обойти требование клеток памяти в костимуляторных функциях АПК. Отсутствие усиления ответов в присутствии экзогенных АПК указывает на ведущую роль распознавания аллоантигена на поверхности аллогенных АПК, как облученных, так и убитых прогреванием. Этот результат полностью подтвердился при тестировании ответов спленоцитов иммунных животных на прогретые аллогенные клетки мышей-нокаутов по генам TAP-1 и b2-микроглобулина. У этих нокаутов происходит синтез тяжелых цепей молекул MHC класса I и их расщепление протеасомой, но нарушен процесс сборки полных макромолекулярных комплексов тяжелых цепей с пептидами и b2-микроглобулином, что приводит к отсутствию молекул MHC класса I на мембране клеток этих мышей и, как следствие, почти полному отсутствию клеток CD8+ в тимусе и периферических лимфоидных органах таких мышей. [28-30]. Согласно нашему замыслу, если бы клетки памяти возникали вследствие кросс-примирования путем переноса пептидов тяжелых цепей молекулы H-2Kb белками теплового шока в АПК мышей R101 с последующей презентацией в контексте молекулы H-2Db, являющейся общим рестриктирующим элементом для мышей C57BL/10 и B10.D2(R101), мы получили бы одинаковые по интенсивности ответы клеток памяти как на стимуляторы мышей дикого типа, так и на стимуляторы мышей мутантов.
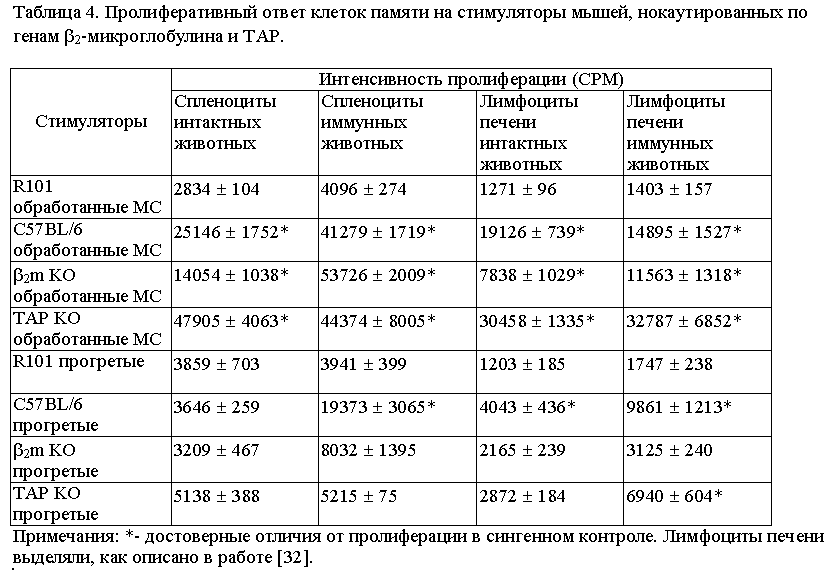
В таблице 4 представлены данные, свидетельствующие о том, что пролиферативные ответы клеток памяти на прогретые стимуляторы
мутантов значительно снижены по сравнению с ответом на стимуляторы дикого типа. В таблице также представлены данные по
тестированию ответов клеток памяти, содержащихся в популяции мононуклеаров печени иммунных мышей. Эти данные показывают
способность определяемых нами клеток к миграции через нелимфоидные ткани, что является одной из характеристических
особенностей клеток памяти [31]. Обработка стимуляторов митомицином C (MC) полностью сохраняет их способность стимулировать
ответы на аллогенные молекулы MHC класса II, присутствующие как на мембране клеток мутантов, так и на мембранах клеток
мышей дикого типа. Способность лимфоцитов печени к ответу на такие стимуляторы показывает сходство Т-клеток, мигрирующих
через ткани, с Т-лимфоцитами лимфоидных органов в их реактивности на аллоантигены.
Таким образом, для успешного распознавание аллоантигена и дальнейшей пролиферации Т-клетки памяти должны
"увидеть" интактную структуру полноразмерного комплекса молекулы H-2Kb на поверхности аллогенной клетки,
убитой прогреванием. Полученные результаты свидетельствуют о том, что клетки памяти CD8+, полученные
в ответе на иммунизацию индивидуальным аллоантигеном опухолевых клеток, распознают молекулу аллоантигена в соответствии
с механизмом прямого аллогенного распознавания. Роль профессиональных АПК, содержащихся в популяции спленоцитов
иммунных животных, которая была выявлена при исследовании ответов на прогретые аллогенные клетки, описанном в предыдущем
разделе, состоит в предоставлении клеткам памяти необходимых костимуляторных сигналов, но не в реализации их
антигенпрезентирующей функции.
Получение и характеристика клонов и Т-гибридом клеток памяти. Поликлональный аллогенный иммунный ответ
определяется ответом множества индивидуальных клонов, которые могут обладать различной специфичностью, распознавать
аллоантиген в соответствии с различными механизмами и иметь различные функциональные свойства. Эти особенности могут
в значительной мере влиять на интенсивность и специфичность аллогенного ответа репертуара реципиента в целом. По этой
причине нам следовало на уровне ответов индивидуальных Т-клеточных клонов проверить, действительно ли в используемой
нами системе определения клеток памяти имеет место прямое распознавание аллоантигена H-2Kb рецепторами
Т-лимфоцитов. Для этого мы использовали два подхода. Один из них заключался в получении клонов после обогащения клеток
памяти иммунного реципиента в ответе на прогретые аллогенные АПК и в последующей рестимуляции прогретыми или облученными
аллогенными АПК в условиях лимитирующих разведений в присутствии IL-2. Результаты представлены в таблице 5.
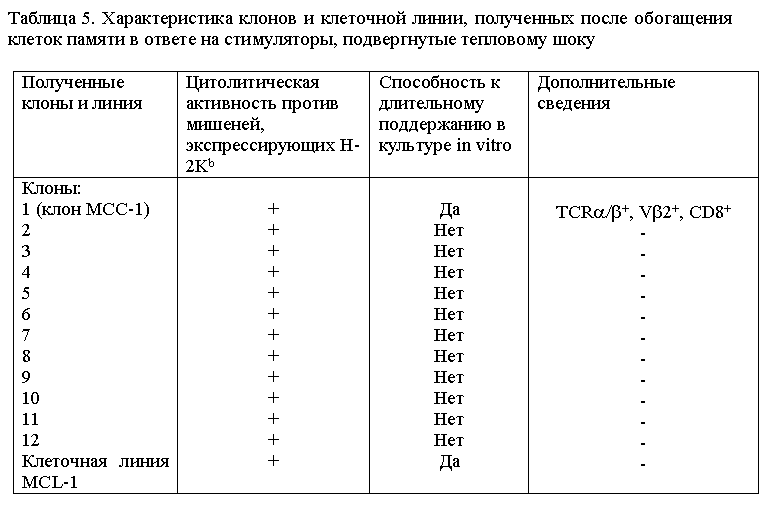
Из 12 полученных клонов все были способны к лизису мишеней, несущих молекулу H-2Kb. Таким образом, подавляющее
большинство клеток (не менее 90%), пролиферирующих в ответ на прогретые аллогенные стимуляторы, являются
предшественниками CTL. Только один клон из 12, названный нами MCC-1, и линия, полученная при рестимуляциях прогретыми
клетками, оказались долгоживущими и способными к длительному поддержанию in vitro. Как и следовало ожидать,
клон MCC-1 экспрессирует TCRa/b и корецептор CD8. Методом RT-PCR с использованием
консенсусных праймеров для определения аллелей b-цепей TCR мы показали, что он экспрессирует
только Vb2 аллель b-цепи Т-клеточного рецептора
(данные не представлены). Этот факт свидетельствует о гомогенности полученного клона. Длительное поддержание этого клона
в культуре in vitro оказалось возможным осуществлять простым добавлением антител к CD3 (супернатант гибридомы 145-2C11
в разведении 1/200) и IL-2 без добавления каких-либо АПК. Характеристика спектра продуцируемых им цитокинов и маркеров
представлена в таблице 6.
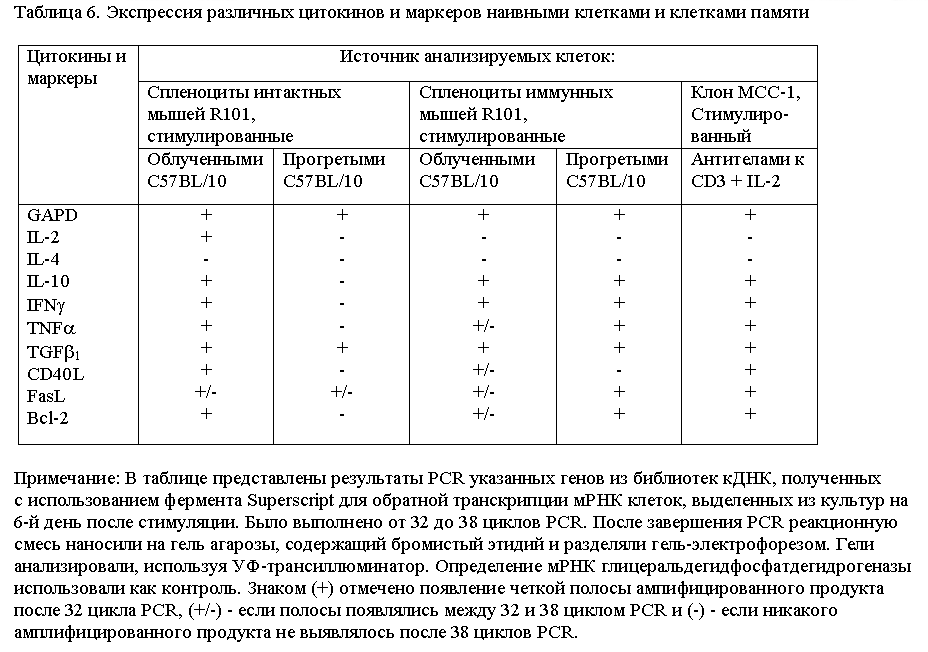
Из представленных результатов хорошо видно, что в этих условиях клон MCC-1 экспрессирует мРНК цитокинов, характерных
для активированных CTL при полном отсутствии мРНК цитокинов клеток хелперной группы. Паттерн экспрессируемых
цитокинов весьма сходен с таковым у поликлональной популяции клеток памяти, отвечающих как на облученные, так и на
прогретые аллогенные стимуляторы. Неожиданным свойством поликлональных популяций клеток памяти оказалось отсутствие в
них после стимуляции мРНК IL-2, что говорит о возможности их пролиферации в отсутствие этого цитокина. Экспрессия в
лимфоцитах иммунных животных мРНК цитокинов TGFb1 и IL-10, способных поддерживать
рост клеток CD45RO+ in vitro, может служить подтверждением тому, что как полученный клон, так и поликлональная
популяция, отвечающая пролиферацией на прогретые аллогенные клетки, действительно представляют собой клетки памяти [33].
Как и следовало ожидать, в наивных лимфоцитах, стимулированных прогретыми клетками, не обнаруживается мРНК цитокинов,
экспрессируемых при иммунной стимуляции, что сопровождается утратой экспрессии гена bcl-2. В отличие от клеток памяти,
стимуляция наивных лимфоцитов облученными аллогенными стимуляторами сопровождается экспрессией мРНК IL-2, что вполне
объяснимо активацией аллореактивных клеток CD4+, распознающих аллогенные молекулы MHC класса II на облученных
стимуляторах. Несмотря на кажущуюся гомогенность клеток клона MCC-1, обнаруживаемую при типировании аллелей
b-цепей, клон обладает выраженной кросс-реактивностью с мишенями, экспрессирующими другие
аллельные формы MHC класса I, чем H-2Kb.
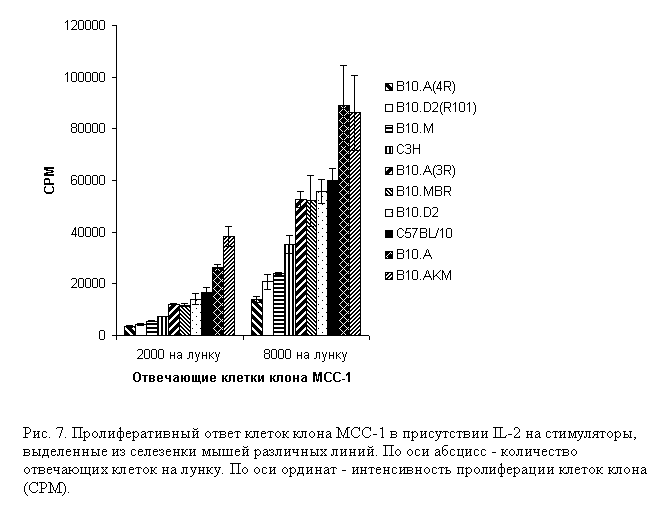
Как следует из анализа пролиферативных ответов клона на панели
стимуляторов, выделенных из различных мышиных линий, конгенных и неконгенных по комплексу H-2, результаты которого
представлены на Рис. 7, продукты MHC H-2Dd(Ld) и H-2Dq(Lq) вызывают более
интенсивную пролиферацию клона, чем иммунизирующий аллоантиген H-2Kb. Таким образом, клон MCC-1 можно
охарактеризовать как гетероклитический. По всей видимости, это его свойство нельзя рассматривать как частный случай,
применимый к индивидуальному клону, поскольку мы часто наблюдали высокий уровень перекрестных реакций поликлональных
популяций клеток памяти мышей R101 со стимуляторами, выделенными из мышей B10.A (KkIkDdLd).
Весьма сильным средством анализа специфичности репертуара на клональном уровне является технология получения
и тестирования Т-клеточных гибридом. Такие гибридомы были нами получены, используя клетки памяти, активированные в ответе
на прогретые аллогенные стимуляторы и партнер для слияния, представляющий собой тимому, трансфецированную CD8a
и LaсZ-опероном под контролем NF-AT-индуцибельного промотора. Роль первой из этих конструкций состоит в обеспечении
стабильности экспрессии корецептора, необходимого для активации Т-клетки, которая может быть измерена по экспрессии
IL-2 гибридомными клетками. Вторая позволяет при необходимости тестировать ответы отдельных клеток на антиген.
С использованием теста, основанного на поддержании роста клеток линии CTLL-2 супернатантами гибридом, стимулированных
в различных условиях, нами получены результаты, представленные в таблице 7.
Таблица 7. Характеристика специфичности репертуара клеток памяти мышей R101,
иммунизированных клетками тимомы EL4
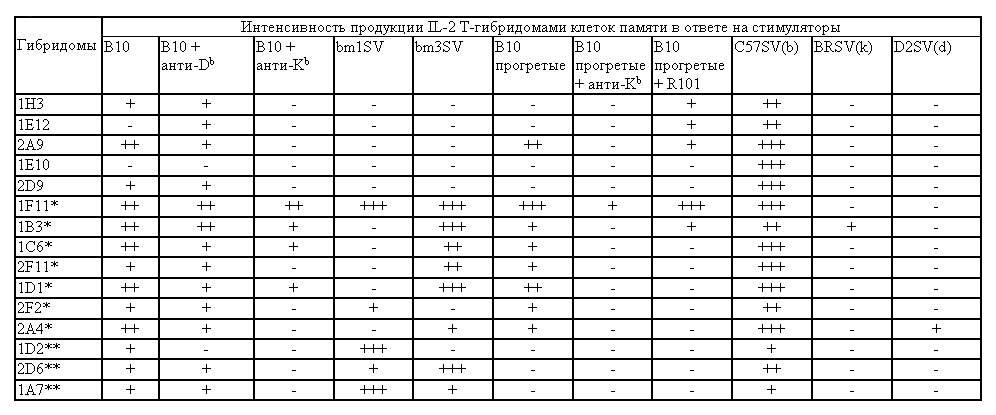
Примечания: Специфичность полученных гибридомных клонов оценивали в ответе на спленоциты мышей C57BL/10 в отсутствие и в
присутствии антител к молекулам H-2Kb (HB41) и H-2Db (28-14.6). Определяли также способность
гибридом отвечать на
прогретые аллогенные стимуляторы в отсутствие и в присутствии антител к молекуле H-2Kb и сингенных спленоцитов
мышей
R101. В качестве стимуляторов, экспрессирующих различные аллельные и мутантные формы молекул MHC класса I и лишенных
экспрессии молекул MHC класса II использовали линии трансформированных фибробластов bm1SV (Kbm1Db),
bm3SV (Kbm3Db),
C57SV (H-2b), BRSV (H-2k), D2SV (H-2d), MSV (H-2f), SSV (H-2s).
Ответ гибридомы считали положительным (+), если он на
3-10 стандартных отклонений превышал средний ответ всех гибридом на сингенные стимуляторы R101. Ответ считали
промежуточным по интенсивности (++), если он превышал средний сингенный ответ на 10-20 стандартных отклонений,
и сильным (+++) - при превышении сингенного ответа более, чем на 20 стандартных отклонений. В связи с тем, что ни
одна из гибридом не отвечала на фибробласты MSV и SSV, в таблице данные не представлены. По характеру ответа клоны
могли быть охарактеризованы как антигенспецифические - 5 гибридом в верхней части таблицы, кросс-реактивные (*)
и гетероклитические (**). Клоны 1E12 и 1E10, по всей видимости, отвечают на большой T-антиген вируса SV40,
использованного для трансформации фибробластов.
Среди 15 гибридом клеток памяти, наиболее
полно изученных нами, можно увидеть 3 различных типа ответа на аллогенные стимуляторы.
К первой группе можно отнести 5 клонов, которые имеют довольно строгую специфичность к антигенам трансформированных
фибробластов C57SV. Из них собственно аллореактивными можно считать лишь 3, реагирующие также со спленоцитами мышей
C57BL/10, тогда как 2 клона - 1E12 и 1E10 - не реагируют ни с какими другими стимуляторами, кроме трансформированных
фибробластов и, по всей видимости, распознают большой Т-антиген вируса SV-40, в свое время использованного для
иммортализации фибробластов [34]. Ответы аллореактивных клонов в этой группе полностью блокируются антителами к молекуле
H-2Kb, но не H-2Db, что указывает на прямое распознавание ими аллоантигена H-2Kb.
Среди этой группы клонов ни один не реагирует с мутантными формами молекулы H-2Kb - Kbm1 (мутация
в остатках 152, 155 и 156 домена a2) и Kbm3 ( мутации в
остатках 77 и 89 домена a1) и только клон 2A9 обладает способностью отвечать
на прогретые аллогенные стимуляторы. Ко второй группе можно отнести гибридомы, характеризующиеся более или менее широким
спектром кросс-реакций с мутантными формами молекулы H-2Kb или с другими аллельными формами молекул MHC.
Для ответов гибридом этой группы характерно то, что все они обладают способностью реагировать на прогретые аллогенные
стимуляторы (хотя и с меньшей интенсивностью, чем на интактные аллогенные клетки) и неполное блокирование их ответов на
интактные аллогенные клетки антителами к H-2Kb. Вместе с тем, их ответ на прогретые аллогенные клетки вполне
эффективно подавляется этими же антителами. Этот факт свидетельствует о возможности прямого распознавания Т-клеткой
аллоантигена на поверхности мертвой аллогенной клетки. Большинство клонов этой группы эффективно реагирует с мутантом bm3,
но не bm1, что свидетельствует о преимущественном взаимодействии рецепторов этой группы клеток с участком тяжелой цепи
a2-домена молекулы H-2Kb.
Последнюю, весьма загадочную группу гибридом характеризует гетероклитический ответ - т.е. способность реагировать на
мутантные формы аллоантигенов со значительно большей интенсивностью, чем на иммунизирующий антиген. Ответы этих гибридом
полностью блокируются как антителами к молекуле H-2Kb, так и прогреванием аллогенных клеток. Таким образом,
данные, полученные нами при иследовании специфичности репертуара клеток памяти на клональном уровне в целом подтвердили
результаты исследований поликлональных популяций клеток памяти. Они являются окончательным доказательством тому, что клетки
памяти, полученные при иммунизации экспериментальных животных аллоантигеном MHC класса I, несут рецепторы, способные к
прямому аллогенному распознаванию антигена, использованного для иммунизации.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В последние годы стало очевидным, что профессиональные АПК играют исключительно важную роль в инициации иммунного ответа. Открытие роли их костимуляторных лигандов и детальное исследование механизма кросс-примирования показали исключительно важную роль дендритных клеток в развитии первичного иммунного ответа. Эти исследования позволили объяснить, как иммунная система может ответить на трансформированные и вирусинфицированные сингенные клетки. Стало известно, что индукция первичного ответа требует тесного контакта Т-лимфоцита CD4+ с профессиональной АПК, обеспечивающего 2 сигнала, требующихся для активации Т-лимфоцита. Специфический сигнал опосредован взаимодействием TCR с комплексом MHC/пептид, тогда как второй костимуляторный сигнал индуцируется взаимодействием CD28 и LFA-1 Т-лимфоцита с B7-1(CD80) и ICAM-1 дендритной клетки. Впоследствии это ведет к индукции экспрессии CD40L на поверхности Т-лимфоцита CD4+, взаимодействие которого с CD40 на АПК включает механизм индуцированной костимуляции ответа, что делает возможной активацию клеток CD8+ кросс-перезентированными антигенами вирусинфицированных и опухолевых клеток, а также способствует вовлечению в ответ других типов АПК. [35-41]. Такая последовательность событий хорошо согласуется с моделью непрямого аллогенного распознавания, согласно которой специфическими лигандами рецепторов Т-лимфоцитов являются фрагменты аллогенных молекул, процессированные и представленные Т-лимфоцитам в контексте молекул MHC реципиента. Вместе с тем это новое знание породило проблему в понимании базового феномена клеточной иммунологии, известного еще в начале нашего века - как может иммунная система реципиента распознавать и эффективно элиминировать трансплантированные клетки аллогенных опухолей, которые лишь в исключительно редких случаях являются профессиональными АПК. Стало также неясным, как в организме может возникнуть иммунный ответ против вирусинфицированных клеток, не являющихся профессиональными АПК. Схема возникновения иммунного ответа, основанная на кросс-примировании Т-клеток дендритными клетками реципиента, не дает ответа на эти, казалось бы простые, вопросы. Ключом к их разрешению могло бы стать выяснение механизма, в соответствии с которым Т-клетки распознают аллоантиген на опухолевых клетках. Если это распознавание непрямое, то важная роль кросс-примирования получила бы дополнительное подтверждение. Если имеет место прямое распознавание, то пришлось бы допустить, что специфический и костимуляторный сигналы, получаемые Т-клеткой, могут быть разделены в пространстве и времени и что возможны условия, в которых профессиональная АПК выполняет лишь костимуляторную функцию, не выполняя своей главной - антигенпрезентирующей функции.
В процессе этой работы мы получили ряд независимых доказательств того, что в процессе иммунного ответа на аллоантиген H-2Kb опухолевых клеток имеет место индукция клеток памяти, способных к прямому распознаванию этого аллоантигена, в том числе, и на поверхности мертвых АПК (Рис. 4, Рис. 6, Табл. 4, Табл. 7). При повторной встрече с тем же антигеном, представленным на поверхности аллогенных клеток, убитых воздействием острого теплового шока, избирательно пролиферируют клетки памяти CD8+, являющиеся предшественниками вторичных CTL, способных к специфическому лизису клеток-мишеней, несущих аллоантиген, использованный для иммунизации (Рис. 1, Рис. 2, Табл. 3, Табл. 5). Индукция этой пролиферации зависит от профессиональных АПК, присутствующих в отвечающей популяции клеток иммунного реципиента, в частности, от костимулирующих лигандов ICAM-1 и CD44H (Рис. 3, Рис. 4, Рис. 5). Костимулирующая функция этих АПК может быть полностью замещена экзогенным IL-2 (Рис. 6). Вместе с тем, пролиферация клеток памяти в ответе на прогретые аллогенные клетки происходит в отсутствие этого цитокина и может быть опосредована цитокинами, которые принято считать супрессорными - IL-10 и TGF-b, мРНК которых клетки памяти CD8+ активно экспрессируют наряду с TNFa и g-IFN после стимуляции аллогенными прогретыми клетками либо антителами к CD3 в присутствии IL-2 (Табл. 6). В этом отношении клетки памяти, тестируемые нами в ответе на прогретые аллогенные стимуляторы, очень похожи на клетки, пролиферацию которых наблюдала S. Rich, обнаружившая пролиферацию клеток CD8+ с фенотипом клеток памяти в ответе на SEB и иммобилизованные антитела к CD3 в присутствии TGF-b [33]. По всей видимости, в ответе на прогретые аллогенные клетки избирательно пролиферируют только клетки памяти, активированные в ходе первичного иммунного ответа in vivo, так как одновременная рестимуляция клеток памяти специфическим и посторонним аллоантигенами не приводит к пролиферации и обогащению клеток, специфичных к посторонним аллоантигенам - т. е. наивные клетки с посторонней специфичностью не вовлекаются в ответ клеток памяти (Рис. 4). Таким образом, пролиферация в ответ на АПК, подвергнутые тепловому шоку может быть высокоизбирательным средством тестирования клеток памяти CD8+, что может иметь важное значение в клинике для мониторинга трансплантационного иммунитета у больных с трансплантированными органами и тканями и противоопухолевого иммунитета у онкологических больных в послеоперационном периоде.
Возможность избирательного обогащения клеток памяти в ответе на прогретые аллогенные клетки открывает широкие перспективы
для их клонирования, оценки специфичности их репертуара на клональном уровне и поиска реальных молекулярных маркеров.
Получение длительно культивируемых клонов нормальных клеток памяти сопряжено с теми же трудностями, что и получение
длительно культивируемых клонов CTL - лишь небольшая доля клонов способна к длительному поддержанию в культуре in vitro,
тогда как большая их часть погибает после первой же рестимуляции. Тем не менее, нам удалось получить и охарактеризовать
долгоживущий клон клеток памяти, который обладает классическим фенотипом CTL - CD8+
TCRa/b+ Perforin+. Ключевой особенностью этого клона оказалась его
способность к гетероклитическому пролиферативному ответу на посторонние аллельные формы молекул MHC -
Dd(Ld) и Dq(Lq) (Рис. 7). В ответе на аллогенные стимуляторы, несущие эти
аллельные формы наблюдается значительно более интенсивная пролиферация клона, чем в ответе на аллоантиген, использованный
для иммунизации. Эта особенность может отражать способность долгоживущих клеток памяти к активации антигенами
микроокружения и лежать в основе высокой протективной эффективности клеток памяти против измененных форм патогенных
вирусов и внутриклеточных микроорганизмов.
Для преодоления малой эффективности клонирования клеток памяти мы также использовали подход, основанный на получении
Т-клеточных гибридом. Ответы практически всех Т-гибридом, реагирующих с иммунизирующим аллоантигеном, подавляются
антителами к молекуле H-2Kb, но не H-2Db, что говорит о распознавании ими аллоантигена в соответствии
с механизмом прямого аллогенного распознавания. Таким образом, как и в исследовании ответов поликлональной популяции
клеток памяти на аллогенные стимуляторы мышей-нокаутов по генам b2-микроглобулина и
TAP (Табл. 4), при исследовании ответов Т-гибридом мы не получили каких-либо свидетельств в поддержку гипотезе о возможности
кросс-примирования клеток памяти фрагментами молекулы аллоантигена. По всей видимости, кросс-примирование может быть лишь
минорной составляющей ответа на "сильные" трансплантационные антигены, прямо взаимодействующие с рецепторами аллореактивных
Т-клеток.
В последние годы методический аппарат, используемый для исследования и характеристики свойств клеток памяти, все чаще
основывается на использовании животных, несущих трансгенные Т-клеточные рецепторы [31, 42-44]. Причина этого явления
заключается в трудности и иногда даже невозможности детекции первичных ответов на индивидуальные пептиды вирусных белков
и микробных клеток, что делает невозможным сравнение свойств наивных клеток и клеток памяти. Хотя использование трансгенных
животных дало возможность увидеть заметные различия в активационном аппарате наивных клеток и клеток памяти, в частности,
в плотности липидных плотиков (lipid rafts) в их мембранах, оно исключает возможность оценки таких различий в их
специфичности [45, 46]. Не привлекая этого параметра в рассмотрение различий между наивными клетками и клетками памяти,
мы не смогли бы объяснить неспособность Т- клеток интактных животных к ответу на прогретые аллогенные стимуляторы.
Мыши, использованные в нашей работе (за исключением нокаутов), содержались в обычных, не spf-условиях, что допускало
возможность развития у них иммунных ответов на антигены микроорганизмов окружающей среды. В организме таких животных
около половины репертуара Т-клеток имеют фенотип клеток памяти и если бы способность к ответу на прогретые аллогенные
стимуляторы была связана с иной организацией их активационного аппарата, то вряд ли мы могли бы увидеть различия в
ответах иммунных и неиммунных животных на прогретые аллогенные клетки.
Различия между наивными клетками и клетками памяти в их способности отвечать на прогретые аллогенные клетки не
связаны с различиями в экспрессии молекул, вовлеченных в миграцию Т-клеток. Как следует из данных, приведенных
в таблице 4, Т-клетки, мигрирующие через нелимфоидные ткани (свойство клеток памяти), способны отвечать на аллоантигены
жизнеспособных АПК так же, как и Т-клетки лимфоидных органов. Вместе с тем, способность обоих типов клеток к ответу на
аллогенные АПК, убитые прогреванием, отсутствует у мышей, не получивших инъекции иммунизирующего аллоантигена.
Вряд ли также различия в ответе на прогретые клетки связано с различиями в частоте антигенреактивных клонов у иммунных и
интактных животных. Согласно нашим данным, через 2 месяца после иммунизации клетками тимомы EL4 частота клоногенных
предшественников, пролиферирующих в ответе на стимуляторы мышей гаплотипа H-2b, не более, чем в 2 раза превышает
их частоту у интактных животных (данные не представлены). Вместе с тем, тестирование ответа гибридом клеток памяти дает
возможность увидеть четкую взаимосвязь способности к ответу на прогретые стимуляторы с кросс-реактивностью на мутантные
формы молекулы H-2Kb, с неполным блокированием их ответов антителами к этому антигену на поверхности интактных
стимуляторов и с полной блокадой ответа на прогретые аллогенные клетки в присутствии таких антител (группа гибридом,
отмеченных знаком * в Табл. 7). Все эти признаки свидетельствуют о высокой аффинности рецепторов Т-клеток памяти,
позволяющей преодолеть такие препятствия для их активации, как мутация в одном из доменов MHC, неспособность прогретых
аллогенных АПК к образованию организованного иммунологического синапса с Т-клетками и даже блокада аллоантигена
антителами. Таким образом, тестирование пролиферативных ответов на стимуляторы, подвергнутые острому тепловому шоку,
позволяет "увидеть" Т-клетки памяти, специфичные к конкретному антигену, "оставляя за кадром" клетки памяти, индуцированные
в ответах на посторонние антигены. Иными словами, клетка памяти, индуцированная в ответе на какой-либо конкретный антиген,
в ответе на другой антиген будет "вести себя" как наивная. Поэтому следует особо подчеркнуть, что разгадка феномена
иммунологической памяти будет невозможной без учета особенностей организации их антигенспецифического рецепторного
аппарата. Очевидно, что эти особенности популяция Т-клеток памяти может приобрести лишь в процессе клональной селекции
после первичной встречи с антигеном. В ответе на молекулу H-2Kb такая селекция приводит к
выживанию клонов, способных к активации в ответ на ее мутантные формы. Наши предварительные результаты указывают на то,
что клетки памяти, находящиеся в печени, способны к активации даже тяжелыми цепями на поверхности прогретых стимуляторов,
выделенных из TAP-нокаутов. Таким образом, вполне вероятно, что селекция клеток памяти может происходить в печени и
быть направленнной на преимущественное выживание клонов с рецепторами, способными к взаимодействию с ограниченными
участками тяжелой цепи молекулы H-2Kb.
В целом, полученные результаты позволяют считать доказанным тот факт, что клетки памяти, индуцированные в ответе на
аллоантиген H-2Kb, распознают его в соответствии с механизмом прямого аллогенного распознавания. Пролиферация
клеток памяти, безусловно, требует костимуляторного сигнала, в качестве которого могут выступать лиганды профессиональных
АПК либо IL-2. Эти факты свидетельствует о возможности получения Т-клеткой памяти специфического и костимуляторного
сигнала от разных клеток, а следовательно, такой механизм активации возможен и в первичном ответе. По всей видимости,
он становится возможным для Т-клеточных клонов с высокой аффинностью рецепторов, позволяющей обойти требование в
формировании организованного иммунологического синапса с аллогенной АПК. Такая схема трехклеточной кооперации показывает
принципиальную возможность и механизм развития эффективного иммунного ответа на трансплантационные антигены опухолевых
клеток, а также на антигены вирусинфицированных и трансформированных клеток, не являющихся профессиональными АПК.
В статьях последних лет, опубликованных в ряде международных иммунологических журналов (как, например, Journal of Immunology
и Immunology Today), посвященных непрямому аллогенному распознаванию, можно встретить интерпретации экспериментальных
результатов, основанные на убеждении авторов в том что ответ на убитые или разрушенные аллогенные клетки a priori является
следствием непрямого аллогенного распознавания [47]. Полученные нами результаты говорят о необходимости очень осторожной интерпретации
таких данных. Теперь очевидно, что иммунные ответы на них ни в коем случае нельзя a priori считать следствием непрямого
распознавания или кросс-примирования Т-клеток антигенами таких АПК.
Авторы выражают глубокую благодарность А. В. Червонскому (Jackson Laboratory, Main, USA) за конструктивную критику,
рекомендации и методическую помощь в выполнении данной работы. Данная работа поддержана грантами РФФИ
(02-04-48686 и 02-04-49042), а также Межведомственной Научно-технической программы "Вакцины нового поколения и медицинские
диагностические системы будущего" (01.04/1).
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1. Yamada H., Nomoto K., Takeya K. // Microbiol. Immunol. 1979. V. 23. P. 357-368.
2. Song C. W., Rhee J. G., Kim T., Kersey J. H., Levitt S. H. // Cancer. Clin. Trials. 1981. V. 4. P. 331-342.
3. Weinberger O., Herrmann S., Mescher M. F., Benacerraf B., Burakoff S. J. // Proc. Natl. Acad. Sci. USA. 1981. V. 78. P. 1796-1799.
4. Vink A. A., Strickland F. M., Bucana C., Cox P. A., Roza D. B., Yarosh D. B., Kripke M. L. // J. Exp. Med. 1996. V. 183. P. 1491-1500.
5. Moscovitch M., Grossman Z., Rosen D., Berke G. // Cell. Immunol. 1986. V. 102. P. 52-67.
6. Matter A., Askonas B.A. // Transplantation 1976. V. 22. P. 184-189.
7. MacDonald H. R., Sordat B., Cerottini J. C., Brunner K. T. // J. Exp. Med. 1975. V. 142. P. 622-636.
8. Hurme M., Bang B. E., Sihvola M. // J. Immunol. 1980. V. 125. P. 2484-2488.
9. Wagner H., Rollinghoff M. // Eur. J. Immunol. 1976. V. 6. P. 15-21.
10. Wagner H., Hess M., Feldmann M., Rollinghoff M. // Transplantation. 1976. V. 21. P. 282-288.
11. Alaba O., Law L. W. // J. Exp. Med. 1978. V. 148. P. 1435-1439.
12. Kazanskii D.B., Petrishchev V.N., Shtil' A.A., Chernysheva A.D., Sernova N.V., Abronina I.F., Pobezinskii L.A., Agafonova E.L. // Russian. J. Bioorg Chem. 1999. V. 25. P. 99-109.
13. Chomczynski P., Sacchi N. // Anal. Biochem. 1987. V. 162. P. 156-159.
14. Kedar E., Chriqui-Zeira E., Mitelman S. // Cancer Immunol. Immunother. 1984. V. 18. P. 126-134.
15. Sladowski D, Steer SJ, Clothier RH, Balls M. // J. Immunol. Methods. 1993. V. 157. P. 203-207.
16. Sanderson S., Shastri N. // Int. Immunol. 1994. V. 6. P. 369-376.
17. van de Loosdrecht A.A., Nennie E., Ossenkoppele G.J., Beelen R.H., Langenhuijsen M.M. // J. Immunol. Methods 1991. V. 141. P. 15-22.
18. Hunt C., Calderwood S. // Gene. 1990. V. 87. P. 199-204.
19. Coss R.A., Linnemans W.A. // Int. J. Hyperthermia 1996. V. 12. P. 173-96.
20. Al-Alwan M.M., Rowden G., Lee T.D., West K.A. // J. Immunol. 2001. V. 166. P. 1452-1456.
21. Shinde S., Wu Y., Guo Y., Niu Q., Xu J., Grewal I.S., Flavell R., Liu Y. // J. Immunol. 1996. V. 157. P. 2764-2768.
22. Evans D.E., Munks M.W., Purkerson J.M., Parker D.C. // J. Immunol. 2000. V. 164. P. 688-697.
23. Benichou G. // Front. Biosci. 1999. V. 4. P. D476-480.
24. Popov IA, Fedoseyeva EV, Orr PL, Garovoy MR, Benichou G. // Transplantation. 1995. V. 60. P. 1621-1624.
25. Bevan M.J. // J. Exp. Med.. 1976. V. 143. P. 1283-1288.
26. Arnold D., Faath S., Rammensee H., Schild H. // J. Exp. Med. 1995. V. 182. P. 885-889.
27. Seder R.A., Germain R.N., Linsley P.S., Paul W.E. // J. Exp. Med. 1994. V. 179. P. 299-304
28. Hughes EA, Hammond C, Cresswell P. // Proc. Natl. Acad. Sci. U S A. 1997. V. 94. P. 1896-1901.
29. Shepherd J.C., Schumacher T.N., Ashton-Rickardt P.G., Imaeda S., Ploegh H.L., Janeway C.A. Jr., Tonegawa S. // Cell. 1993. V. 74. P. 577-584.
30. Apasov S.G., Sitkovsky M.V. // J. Immunol. 1994. 152. P. 2087-2097.
31. Kedl R.M., Mescher M.F. // J. Immunol. 1998. V. 161. P. 674-683.
32. Kazanskii DB, Chernysheva AD, Sernova NV, Abronina IF, Anosova NG, Rodin DV, Pobezinskii LA, Agafonova EL. // Mol. Biol. (Mosk). 1998. V. 32. P. 1036-1043.
33. Rich S., Seelig M., Lee H.M., Lin J. // J. Immunol. 1995. V. 155. P. 609-618.
34. Hess R.D., Kuther M., Haessler C., Paetzold S., Braun D.G., Brandner G. // Cytometry. 1995. V. 20. P. 81-85.
35. Carbone F.R., Bevan M.J. // J. Exp. Med. 1990. V. 171. P. 377-387.
36. Suto R., Srivastava P.K. // Science. 1995. V. 269. P. 1585-1588.
37. Bennett S.R., Carbone F.R., Karamalis F., Miller J.F., Heath W.R. // J. Exp. Med.. 1997. V. 186. P. 65-70.
38. Brossart P., Bevan M.J. // Blood. 1997. V. 90. P. 1594-1599.
39. Albert M.L., Sauter B., Bhardwaj N. // Nature. 1998. V. 392. P. 86-89.
40. Ossendorp F., Mengede E., Camps M., Filius R., Melief C.J. // J. Exp. Med. 1998. V. 187. P. 693-702.
41. Bennett S.R., Carbone F.R., Karamalis F., Flavell R.A., Miller J.F., Heath W.R. // Nature. 1998. V. 393. P. 478-480.
42. Veiga-Fernandes H., Walter U., Bourgeois C., McLean A., Rocha B. // Nat. Immunol. 2000. V. 1. P. 47-53.
43. Grayson J.M., Zajac A.J., Altman J.D., Ahmed R. // J. Immunol. 2000. V. 164. P. 3950-3954.
44. Rogers P.R, Dubey C., Swain S.L. // J. Immunol. 2000. V. 164. P. 2338-2346.
45. Bachmann M.F., Gallimore A., Linkert S., Cerundolo V., Lanzavecchia A., Kopf M., Viola A. // J. Exp. Med. 1999. V. 189. P. 1521-1530.
46. Tuosto L., Parolini I., Schroder S., Sargiacomo M., Lanzavecchia A., Viola A. // Eur. J. Immunol. 2001. V. 31. P. 345-349.
47. Gould D.S., Auchincloss H. Jr. // Immunol. Today. 1999. V. 20. P. 77-82.